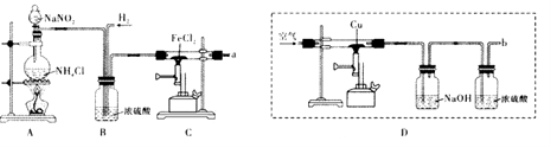
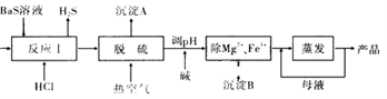
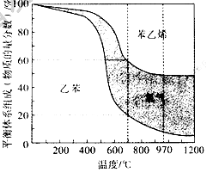
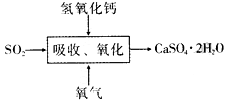
-
下列物质的分离和鉴别方法正确的是
A.用分液法分离碘酒和CCl4
B.用饱和碳酸钠溶液萃取乙醇中的乙酸
C.用银氨溶液鉴别甲酸乙酯和乙醛
D.用浓溴水鉴别苯和环己烯
难度: 中等查看答案及解析
-
下列离子方程式书写正确的是
A.KMnO4溶液用盐酸酸化并加入H2O2 :2MnO4- +6H++5H2O2=2Mn2++5O2↑+8H2O
B.Fe2(SO4)3和Ba(OH)2溶液混合:2Fe3++3SO42 -+3Ba2++6OH-=2Fe(OH) 3↓+3BaSO4↓
C.等体积等物质的量浓度的AlCl3、Ba(OH)2、HCl溶液混合:3H++Al3++6OH-=Al(OH)3↓+3H2O
D.水玻璃与稀醋酸混合:SiO32 -+2H+=H2SiO3↓
难度: 中等查看答案及解析
-
1 mol乙烷与3 mol Cl2在光照条件下反应,理论上得到的氯代物有
A.3种 B.5种 C.7种 D.9种
难度: 中等查看答案及解析
-
有关化学反应的方向和速率的研究可以指导化工生产。下列说法正确的是
A.N2+3H2
2NH3
H<0,在任何温度下均为自发反应
B.向新制氯水中加入少量小苏打固体可提高其漂白能力
C.1 L密闭容器中发生反应4NH3 +5O2
4NO+6H2O ,充人少量 N2可加快反应速率
D.湿法炼铜的反应为Fe+CuSO4=FeSO4 +Cu ,反应中的Fe可以用Na代替
难度: 中等查看答案及解析
-
25 ℃时,H2SO3
HSO3- +H+的电离平衡常数Ka=1×10-2 ,下列说法不正确的足
A.该温度下NaHSO3 的水解平衡常数Kb=1×10-12
B.若向NaHSO3 溶液中加入少量的I2,则溶液中c(H2SO3) /c(HSO3- ) 将减小
C.略微升高温度 Ka(H2SO3)和Kh(NaHSO3 )均增大
D.NaHSO3溶液中:c(H+)<c(SO32 -)+c(HSO3- )+c(OH-)
难度: 中等查看答案及解析
-
铝是一种高能量载体,是开发电池的理想电极材料。如图所示的室温铝二次电池,采用有机阳离子(EMIm)和AlCl4-组成的离子液体为电解液,有关反应为Al+Mn2O4
AlMn2O4 下列说法正确的是
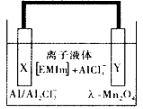
A.电池放电时,AlCl4-向Y极扩散
B.电池放电时,X是正极
C.电池充电时X极的反应为:4Al2Cl7- +3e-=Al+7AlCl4-
D.铝作为负极材料的比能量高于锂
难度: 中等查看答案及解析
-
位于不同短周期的两种主族元素X、Y,已知Y的原子序数为X的2倍,下列说法正确的是
A.X元素原子的半径一定小于Y元素原子的半径
B.Y元素的氧化物不可能与X元素的气态氢化物反应
C.X元素与氢元素形成的化合物中一定不含非极性键
D.Y元素与X元素原子的最外层电子数一定不相等
难度: 中等查看答案及解析