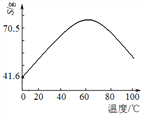
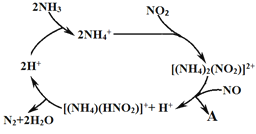
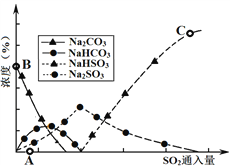
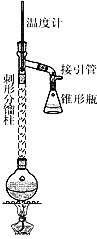
-
人类必须尊重自然、顺应自然、保护自然。下列做法符合上述理念的是
A. 开发太阳能等新能源汽车 B. 工业污水直接用于灌溉农田
C. 焚烧废旧塑料防止“白色污染” D. 推广露天烧烤丰富人们饮食
难度: 中等查看答案及解析
-
下列有关物质性质与用途具有对应关系的是
A. Si的熔点高,可用作半导体材料
B. SO2具有氧化性,可用于漂白纸浆
C. Na2CO3溶液呈碱性,可用于洗涤油污
D. Al2O3硬度很大,可用于制造耐火材料
难度: 中等查看答案及解析
-
X、Y、Z、W均为短周期主族元素,原子序数依次增大。X与Z位于同一主族,Z的核外电子数是X的2倍,Y、Z、W原子的最外层电子数之和等于Z的核外电子总数。下列说法正确的是
A. 原子半径:r(X)<r(Y)<r(Z)
B. Y的氧化物能与氢氧化钠溶液反应
C. Z的氧化物对应的水化物均为强酸
D. Z的气态氢化物的稳定性比W的强
难度: 中等查看答案及解析
-
下列说法正确的是
A. 反应2NaCl(s)=2Na(s)+Cl2(g) 的ΔH<0,ΔS>0
B. 常温下,将稀CH3COONa溶液加水稀释后,n(H+)·n(OH-)不变
C. 合成氨生产中将NH3液化分离,可加快正反应速率,提高H2的转化率
D. 氢氧燃料电池工作时,若消耗标准状况下11.2 L H2,则转移电子数为6.02×1023
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
实验结论
A
向苯酚浊液中加入Na2CO3溶液,溶液变澄清
酸性:苯酚>HCO3-
B
将少量Fe(NO3)2加水溶解后,滴加稀硫酸酸化,再滴加KSCN溶液,溶液变成血红色
Fe(NO3)2已变质
C
氯乙烷与NaOH溶液共热后,滴加AgNO3溶液,生成白色沉淀
氯乙烷发生水解
D
在2 mL 0.01 mol·L-1的Na2S溶液中先滴入几滴0.01 mol·L-1 ZnSO4溶液有白色沉淀生成,再滴入0.01 mol·L-1 CuSO4溶液,又出现黑色沉淀
Ksp(CuS)<Ksp(ZnS)
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
A. 中子数为8的氧原子:
B. 氯离子的结构示意图:
C. Na2S的电子式:
D. 2–丙醇的结构简式:(CH3)2CHOH
难度: 中等查看答案及解析
-
下列关于NO2的制取、净化、收集及尾气处理的装置和原理不能达到实验目的的是
A.
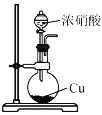 制取NO2 B.
制取NO2 B.  净化NO2
净化NO2C.
 收集NO2 D.
收集NO2 D. 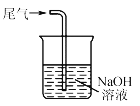 尾气处理
尾气处理难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 氯化铁溶液溶解铜片:Fe3++ Cu=Fe2++ Cu2+
B. 氯气与水反应:Cl2 + H2O
2H+ + Cl-+ ClO-
C. 硝酸银溶液中加入过量氨水:Ag+ + NH3·H2O=AgOH↓+ NH4+
D. Ca(HCO3)2溶液与少量NaOH溶液反应: Ca2++ HCO3-+ OH-=CaCO3↓+ H2O
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是
A.
B.
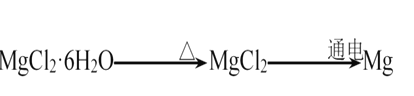
C.

D.
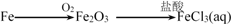
难度: 中等查看答案及解析
-
通过以下反应均可获取O2。下列有关说法不正确的是
①光催化分解水制氧气:2H2O(l)=2H2(g) + O2(g) ΔH1=+571.6 kJ·mol-1
②过氧化氢分解制氧气:2H2O2(l)=2H2O(l) + O2(g) ΔH2=-196.4 kJ·mol-1
③一氧化氮分解制氧气:2NO(g)=N2(g) + O2(g) ΔH3=-180.5 kJ·mol-1
A. 反应①是人们获取H2的途径之一
B. 反应②、③都是化学能转化为热能
C. 反应H2O2(l)=H2O(g)+
O2(g)的ΔH=-98.2 kJ·mol-1
D. 反应2H2(g)+2NO(g)=N2(g)+2H2O(l)的ΔH=-752.1 kJ·mol-1
难度: 困难查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 能使甲基橙变红的溶液中:K+、Mg2+、NO3-、I-
B. c(HCO3-)=1 mol·L-1溶液中:Na+、NH4+、SO42-、OH-
C. 无色透明的溶液中: Fe3+、Al3+、NO3-、SO42-
D.
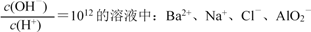
难度: 中等查看答案及解析
-
下列图示与对应的叙述相符合的是
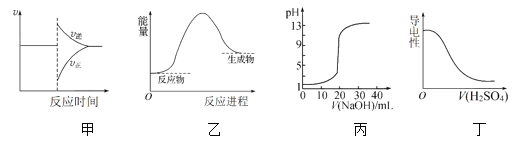
A. 图甲表示对某化学平衡体系改变温度后反应速率随时间的变化
B. 图乙表示反应物断键吸收的能量大于生成物成键放出的能量
C. 图丙表示0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1硫酸时溶液pH的变化
D. 图丁表示向Ba(OH)2溶液中滴加稀H2SO4至过量,溶液的导电性变化情况
难度: 中等查看答案及解析
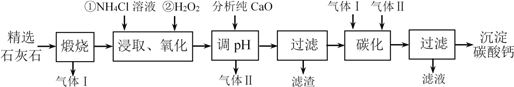
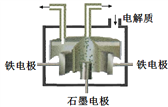
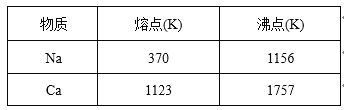

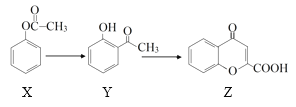
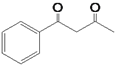 的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________
的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)。___________________