-
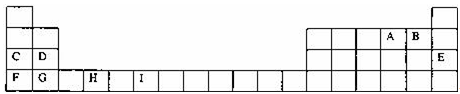
道尔顿的原子学说曾经起了很大的作用。他的学说中主要有下列三个论点:①原子是不能再分的微粒;②同种元素的原子的各种性质和质量都相同;③原子是微小的实心球体。从现代原子——分子学说的观点看,你认为不正确的是 ( )
A.只有① B.只有② C.只有③ D.①②③
难度: 中等查看答案及解析
-
以下化学用语正确的是( )
A.乙烯的结构简式:CH2CH2 B.乙醇的分子式:CH3CH2OH
C.CH2F2的电子式:
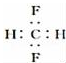 D.甲醛的结构式:
D.甲醛的结构式:难度: 中等查看答案及解析
-
在单质的晶体中一定不存在的微粒是 ( )
A.原子 B.分子 C.阴离子 D.阳离子
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.Na、Mg、Al的第一电离能逐渐增大
B.V、Cr、Mn的最外层电子数逐渐增大
C.S2﹣、Cl﹣、K+的半径逐渐减小
D.O、F、Ne的电负性逐渐增大
难度: 中等查看答案及解析
-
已知次氯酸分子的结构式为H﹣O﹣Cl,下列有关说法正确的是( )
A.依据其结构判断该含氧酸为强酸
B.O原子与H、Cl都形成σ键
C.该分子为直线形非极性分子
D.该分子的电子式是H:O:Cl
难度: 中等查看答案及解析
-
下列无机含氧酸分子中酸性最强的是( )
A.HNO2 B.H2SO3 C.HClO3 D.HClO4
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
A.最高正化合价:③>②>① B.第一电离能:③>②>①
C.电负性:③>②>① D.原子半径:③>②>①
难度: 中等查看答案及解析
-
某短周期元素R原子的最外层P轨道上的未成对电子只有2个.下列关于R的描述中正确的是 ( )
A.R的氧化物都能溶于水
B.R的最高价氧化物对应的水化物都是H2RO3
C.R是非金属元素
D.R的氧化物都能与NaOH溶液反应
难度: 中等查看答案及解析
-
下列大小关系正确的是( )
A.熔点:NaI>NaBr
B.硬度:MgO>CaO
C.晶格能:NaCl<NaBr
D.熔沸点:CO2>NaCl
难度: 简单查看答案及解析
-
徐光宪在《分子共和国》一书中介绍了许多明星分子,如H2O2、CO2、BF3、CH3COOH等.下列说法正确的是( )
A.H2O2分子的空间构型为直线形
B.CO2分子为非极性分子
C.BF3分子中的B原子满足8电子稳定结构
D.CH3COOH分子中C原子均为sp2杂化
难度: 中等查看答案及解析
-
在白磷(P4)分子中,4个P原子分别处在正四面体的四个顶点,结合有关P原子的成键特点,下列有关白磷的说法正确的是( )
A.白磷分子的键角为109∘28′ B.分子中共有4对共用电子对
C.白磷分子的键角为60∘ D.分子中有6对孤对电子
难度: 中等查看答案及解析
-
下列有关核外电子排布的式子不正确的是 ( )
A.24Cr的电子排布式:1s22s22p63s23p63d54s1
B.K的简化电子排布式:[Ar]4s1
C.N原子的电子排布图:

D.S原子的电子排布图:

难度: 中等查看答案及解析
-
某研究所合成了一种球形分子,它的分子式为C60Si60,其结构中包含有C60和Si60。下列对该分子的叙述中正确的是 ( )
A.形成的晶体属于分子晶体 B.分子中Si60被包裹在C60里面
C.其摩尔质量为2400 D.熔点高、硬度大
难度: 中等查看答案及解析
-
向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解,得到深蓝色的透明溶液。下列对此现象说法正确的是( )
A.反应后溶液中不存在任何沉淀,所以反应前后[Cu(H2O)4]2+的数目不变
B.沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+
C.向反应后的深蓝色溶液中加入乙醇,不会产生任何现象
D.在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道
难度: 中等查看答案及解析
-
根据键能数据估算CH4(g)+4F2(g)═CF4(g)+4HF(g)的反应热△H为( )
化学键 C﹣H C﹣F H﹣F F﹣F
键能/(kJ/mol) 414 489 565 155
A.﹣1940 kJ/mol B.+1940 kJ/mol C.﹣485 kJ/mol D.+485 kJ/mol
难度: 中等查看答案及解析
-
下列分子中有2个手性碳原子的是( )
A.乳酸:CH3﹣CHOH﹣COOH
B.甘油:CH2OH﹣CHOH﹣CH2OH
C.脱氧核糖:CH2OH﹣CHOH﹣CHOH﹣CH2﹣CHO
D.核糖:CH2OH﹣CHOH﹣CHOH﹣CHOH﹣CHO
难度: 中等查看答案及解析
-
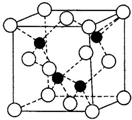
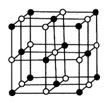
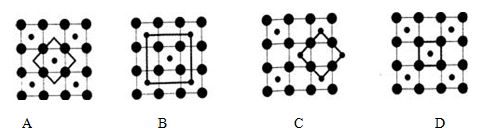
磷化硼是一种超硬耐磨涂层材料。下图为其晶体结构中最小的重复结构单元,其中的每个原子均满足8电子稳定结构。下列有关说法正确的是( )

A.磷化硼晶体的化学式为BP,属于离子晶体
B.磷化硼晶体的熔点高,且熔融状态下能导电
C.磷化硼晶体中每个原子均形成4条共价键
D.磷化硼晶体结构微粒的空间堆积方式与氯化钠相同
难度: 困难查看答案及解析
-
0.01mol氯化铬(CrCl3•6H2O)在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为( )
A.[Cr(H2O)5Cl]Cl2•H2O
B.[Cr(H2O)4Cl2]Cl•2H2O
C.[Cr(H2O)6]Cl3
D.[Cr(H2O)3Cl3]•3H2O
难度: 中等查看答案及解析