-
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍.回答下列问题:
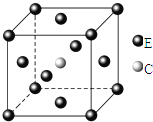
(1)B2A4分子中B原子轨道的杂化类型为________,B2A4分子中σ键和π键个数比为________
(2)A、B、C、D四种元素的电负性从大到小的顺序为________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是________
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是________
(4)元素E能形成多种配合物,如:E(CO)5等.
①基态E原子的价电子排布式为________.
②E(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于________(填晶体类型),该晶体中E的化合价为________
-
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)B2A4分子中B原子轨道的杂化类型为 ,B2A4分子中σ键和π键个数比为 。
(2)A、B、C、D四种元素的电负性从大到小的顺序为______________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是 。
(4)元素E能形成多种配合物,如:E(CO)5等。
①基态E原子的价电子排布图为 。
②E(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于 (填晶体类型),该晶体中E的化合价为 。
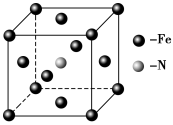
(5)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为_______。若两个最近的E原子间的距离为acm,则该晶体的密度是______g·mL-1。
-
原子序数依次递增且都小于36的A、B、C、D、E五种元素,其中A的一种核素中没有中子,B原子基态时最外层电子数是其内层电子数的2倍,D原子基态时2p原子轨道上有2个未成对的电子,E元素的原子结构中3d能级上未成对电子数是成对电子数的2倍。回答下列问题:
(1)B2A4分子中B原子轨道的杂化类型为 ,B2A4分子中σ键和π键个数比为 。
(2)A、B、C、D四种元素的电负性从大到小的顺序为______________(用元素符号表示);化合物CA3的沸点比化合物BA4的高,其主要原因是 。
(3)元素B的一种氧化物与元素C的一种氧化物互为等电子体,元素C的这种氧化物的分子式是 。
(4)元素E能形成多种配合物,如:E(CO)5等。
①基态E原子的价电子排布图为 。
②E(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断E(CO)5晶体属于 (填晶体类型),该晶体中E的化合价为 。
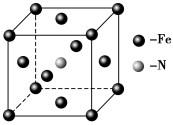
(5)E和C形成的一种化合物的晶胞结构如图所示,该晶胞的化学式为_______。若两个最近的E原子间的距离为acm,则该晶体的密度是______g·mL-1。
-
短周期元素M、W、X、Y、Z的原子序数依次增大,M元素的一种核素没有中子,且M、W、X、Y+、Z的最外层电子数与其电子层数的比值依次为1、2、3、4、2(不考虑零族元素),下列关于这些元素的叙述正确的是( )
A. X分别和其它四种元素均可形成至少2种化合物
B. M分别和w、X、Y、Z形成化合物,均显相同化合价
C. M、X、Z三种元素组成的化合物含有离子键
D. M、X、Y组成化合物和Y、Z组成化合物,它们所含的化学键类型完全相同
-
短周期元素W、X、Y、Z、M的原子序数依次增大,元素W的一种核素的中子数为0,X的原子最外层电子数是次外层的2倍,Z与M同主族,Z2−电子层结构与氖相同。
(1)M位于元素周期表中第______周期______族。
(2)化合物p由W、X、Y、M四种元素组成。已知向p溶液中加入FeCl3溶液,溶液变血红色;向p溶液中加入NaOH溶液并加热可放出使湿润的红色石蕊试纸变蓝的气体。p的化学式为_________。
(3)由X、Y、Z三种元素可组成摩尔质量为84g/mol的物质q,且q分子中三种元素的原子个数之比为1:1:1。已知q分子中各原子均达到8电子稳定结构,且分子中不含双键,但含极性键和非极性键,q分子的结构式为_______________。
(4) (XY)2的性质与Cl2相似,(XY)2与NaOH溶液反应的离子方程式为_________。
-
X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素。X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示,N是用量最多的金属元素。下列说法不正确的是
A. 原子半径:W>Y>Z>M>X
B. N的一种氧化物可用作油漆和涂料
C. 热稳定性:XM>X2Z
D. X2Z、WM4分子中各原子最外层均为8电子稳定结构
-
X、Y、Z、M、W、N六种元素的原子序数依次增大,其中X、Y、Z、M、W为五种短周期元素。X元素的某种核素无中子,W原子核外电子数是M原子最外层电子数的2倍,Y、Z、M、W在周期表中的相对位置如图所示,N是用量最多的金属元素。下列说法不正确的是
A.原子半径:W>Y>Z>M>X
B.N的一种氧化物可用作油漆和涂料
C.氢化物的沸点:Z小于M
D.工业上制备W单质的方法为电解熔融的W的氧化物
-
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的主族元素。请回答下列问题:
(1)C在元素周期表中的位置为______________,G的原子结构示意图是___________。
(2)D与E按原子个数比1:1形成化合物甲,其电子式为____________________,所含化学键类型为_____________________________________。向甲中滴加足量水时发生反应的化学方程式是________________________________。
(3)E、F、G形成的简单离子,半径由大到小顺序是____________。(用离子符号表示)
(4)用BA4、D2和EDA的水溶液组成燃料电池,电极材料为多孔惰性金属电极。在a极通入BA4气体,b极通入D2气体,负极的电极反应式为_______________________________
-
原子序数依次递增 且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子。回答下列问题:
(1)Y2X2分子中Y原子轨道的杂化类型为 ,Y2X2分子中σ键和π键个数比为 。
(2)化合物ZX3的沸点比化合物YX4的高,其主要原因是 。
(3)元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,元素Z的这种氧化物的分子式是 。
(4)元素W能形成多种配合物,如:W(CO)5等。
①基态W3+的M层电子排布式为 。
② W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于 晶体(填晶体类型),该晶体中W的化合价为 。
W(CO)5常温下呈液态,熔点为—20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断W(CO)5晶体属于 晶体(填晶体类型),该晶体中W的化合价为 。
(5)下列有关的说法正确的是 。
A.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
B.电负性顺序:X<Y<Z<Q
C.因为晶格能CaO比KCl高,所以KC l比CaO熔点低
l比CaO熔点低
D.H2 YO3的分子结构中含有一个非羟基氧,故其为中强酸
(6)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图4,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= pm。(用含ρ、NA的计算式表示)

-
W、X、Y、Z为原子序数递增的四种短周期元素。W是原子半径最小的元素,X的一种核素在考古时常用来鉴定一些文物的年代,Y是植物生长所需化学肥料中主要的营养元素之一,Z原子的最外层电子数是X原子最外层电子数的1.5倍。下列说法正确的是( )
A. 氢化物的沸点:Z一定高于Y
B. 最高价氧化物对应水化物的酸性:X强于Y
C. 仅由W、Y、Z三种元素组成的化合物不可能属于盐类
D. W、X、Y、Z都能分别与氯元素形成共价化合物



