-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)<c(SO42-)
B.2c(NH4+)=c(SO42-)
C.c(NH4+)>c(SO42-)
D.c(OH-)+c(SO42-)=c(NH4+)+c(H+)难度: 中等查看答案及解析
-
下列各种情况下,可以大量共存的离子组是( )
A.使pH试纸呈红色的溶液中:Fe3+、NO3-、SO42-、Na+
B.由水电离的c(H+)=1×10-14mol/L的溶液中:Ba2+、K+、Cl-、HCO3-
C.与Al反应放出大量氢气的溶液中:NH4+、SO42-、CO32-、Na+
D.使紫色石蕊变蓝的溶液中:NH4+、Al3+、Ca2+、Cl-难度: 中等查看答案及解析
-
2008年北京奥运会“祥云”火炬用的是环保型燃料--丙烷(C3H8),悉尼奥运会火炬所用燃料65%丁烷(C4H10)和35%丙烷,已知丙烷的燃烧热为:2221.5kJ•mol-1,下列有关说法正确的是( )
A.奥运火炬燃烧主要是将化学能转变为热能和光能
B.丙烷的沸点比正丁烷高
C.丙烷、空气及铂片可组成燃料电池,在丙烷附近的铂极为电池的正极
D.丙烷燃烧的热化学方程式为:C3H8+5O2→3CO2+4H2O△H=-2221.5kJ•mol-1难度: 中等查看答案及解析
-
下列说法正确的是( )
A.凡是放热反应都是自发的,由于吸热反应都是非自发的
B.自发反应一定是熵增大,非自发反应一定是熵减少或不变
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现难度: 中等查看答案及解析
-
下列实验装置图操作正确的是( )
A.
称量氢氧化钠固体
B.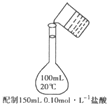
配置150mL•0.10mol•L-1盐酸
C.
Fe(OH)3液体的制备
D.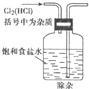
除杂难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式的是( )
A.NH4HCO3溶液中加入足量NaOH溶液共热:NH4++OH-NH3↑+H2O
B.Na2CO3溶液中通入少量SO2:2CO32-+SO2+H2O=2HCO3-+SO32-
C.CuSO4溶液中加入Ba(OH)2溶液:SO42-+Ba2+=BaSO4↓
D.用食醋溶解水垢:CaCO3+2H+=Ca2++CO2↑+H2O、Mg(OH)2+2H+=Mg2++2H2O难度: 中等查看答案及解析
-
对于可逆反应:4NH3(g)+5O2(g)
4NO(g)+6H2O(g),下列叙述正确的是( )
A.化学反应速率关系是:2V正(NH3)=3V正(H2O)
B.达到化学平衡时,4V正(O2)=5V逆(NO)
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.若单位时间内生成xmolNO的同时,消耗xmolNH3,则反应达到平衡状态难度: 中等查看答案及解析
-
下列除去括号内杂质的有关操作方法正确的是( )
①CO2(SO2):饱和NaHCO3的溶液,洗气.②KCl(AlCl3):氨水,过滤.③C2H6(C2H4):溴的CCl4溶液,洗气.④水(碘):酒精,萃取分液.⑤苯(甲苯):分馏.
A.①②③
B.③④⑤
C.②④
D.①③⑤难度: 中等查看答案及解析
-
在碳原子数n≤10的所有烷烃的同分异构体中,其一氯取代物只有一种的共有( )
A.4种
B.3种
C.2种
D.无法确定难度: 中等查看答案及解析
-
在一密闭容器中,反应mA(g)
nB(g)+nC(g)达到平衡后,保持温度不变,将容器体积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则( )
A.平衡向正反应方向移动了
B.物质A的转化率增加了
C.物质C的质量分数增加了
D.m<2n难度: 中等查看答案及解析
-
反应速率υ和反应物浓度c的关系是用实验方法测定的.化学反应H2+Cl2═2HCl的反应速率υ可表示为υ=k[c(H2)]m•[c(Cl2)]n,式中k为常数,m、n值可用下表中的数据确定.由此可推得,m、n值正确的是( )
c(H2) c(Cl2) υ 1.0 1.0 1.0k 2.0 1.0 2.0k 2.0 4.0 4.0k
A.m=1,n=1
B.
C.
D.难度: 中等查看答案及解析
-
下列说法正确的是( )
A.增大压强,活化分子数增加,化学反应速率一定增大
B.升高温度,活化分子百分数增加,化学反应速率一定增大
C.活化分子间所发生的分子间的碰撞为有效碰撞
D.加入反应物,使活化分子百分数增加,化学反应速率增大难度: 中等查看答案及解析
-
在恒温恒容下发生反应:N2(g)+3H2(g)
2NH3(g)△H<0.下列判断不正确的是( )
A.30s内,H2的浓度改变了0.30mol/L,则平均反应速率υ(N2)=0.01mol/
B.当气体总压不随时间改变时,表明该反应达到平衡状态
C.使用铁触媒可明显减少达到平衡的时间
D.降温可提高N2的转化率难度: 中等查看答案及解析
-
反应2X(g)+Y(g)═2Z(g)+热量,在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是( )
A.T1<T2,P1<P2
B.T1<T2,P1>P2
C.T1>T2,P1>P2
D.T1>T2,P1<P2难度: 中等查看答案及解析
-
25℃时,某溶液中由水电离产生的[H+]和[OH-]的乘积为10-20mol2•L-2,下列叙述正确的是( )
A.该溶液的pH一定是10
B.该溶液可能pH=4
C.该溶液中加入Al一定产生H2
D.不会有这样的溶液难度: 中等查看答案及解析
-
用pH均为2的盐酸和醋酸溶液,分别中和等体积、等物质的量浓度的氢氧化钠溶液,当氢氧化钠恰好被完全中和时,消耗盐酸和醋酸溶液的体积分别为V1和V2,则V1和V2的关系正确的是( )
A.V1>V2
B.V1<V2
C.V1=V2
D.V1≤V2难度: 中等查看答案及解析
-
下列实际应用与盐的水解知识无关的是( )
A.焊接时用NH4Cl溶液除锈
B.使用泡沫灭火器时,使硫酸铝与饱和小苏打溶液混合
C.饱和氯化铁溶液滴入沸水中制备Fe(OH)3胶体
D.生活中用电解食盐水的方法制取消毒液难度: 中等查看答案及解析
-
物质的量浓度各为0.1mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液呈酸性.下列关系式正确的是( )
A.[Na+]+[H+]=[CH3COO-]+[OH-]=0.05mol•L-1
B.[CH3COO-]+[CH3COOH]=0.2mol•L-1
C.[CH3COO-]>[Na+]>[H+]>[OH-]
D.[Na+]>[CH3COO-]>[H+]>[OH-]难度: 中等查看答案及解析
-
按图装置持续通入气体X,并在管口P处点燃,实验结果使澄清石灰水变浑浊,则X、Y可能是( )①H2和NaHCO3 ②CO和Na2CO3 ③CO和CuO ④H2和Fe2O3.

A.①④
B.①③
C.②③
D.③④难度: 中等查看答案及解析
-
某烃的结构简式为:
 ,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
,该分子中含有四面体结构的碳原子(即饱和碳原子)数为a,在同一直线上的碳原子数最多为b,一定在同一平面内的碳原子数为c,则a、b、c分别为( )
A.4、3、5
B.4、3、6
C.2、5、4
D.4、6、4难度: 中等查看答案及解析

