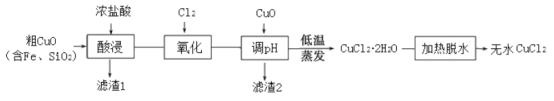
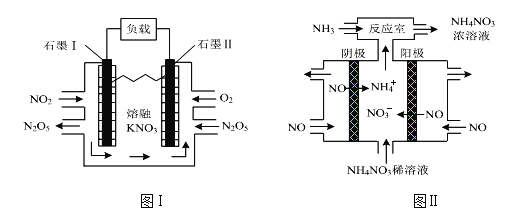
-
化学与生产、生活、社会、环境关系密切,下列说法正确的是
A. NH4Cl和ZnCl2溶液可用作焊接钢铁时的除锈剂
B. 大力生产铅蓄电池、汞锌锰干电池,满足消费需求
C. 工业生产中使用催化剂可改变反应的活化能和焓变
D. 牺牲阳极的阴极保护法是应用电解原理防止金属腐蚀
难度: 简单查看答案及解析
-
室温下,下列事实不能说明NH3•H2O为弱电解质的是
A. 0.1 mol•L-1 NH3•H2O溶液的pH小于13
B. 0.1 mol•L-1 NH4Cl溶液的pH小于7
C. 相同条件下,浓度均为0.1 mol•L-1的NaOH溶液和氨水,氨水的导电能力弱
D. 向0.1 mol•L-1 NH3•H2O溶液中加入MgCl2溶液产生白色沉淀
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g) === 2AB(g)的能量变化如图,下列叙述正确的是
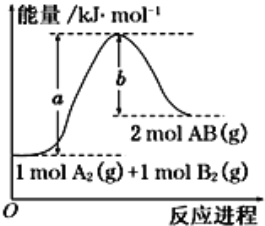
A. 每生成2分子AB吸收b kJ热量
B. 该反应中反应物的总能量高于生成物的总能量
C. 该反应热ΔH=+(a-b) kJ•mol-1
D. 断裂1 mol A—A和1 mol B—B键,放出a kJ能量
难度: 简单查看答案及解析
-
下列叙述中,不能用勒夏特列原理解释的是
A. 合成氨工业使用催化剂,可提高氨的日产量
B. 合成氨工业通常采用高压,以提高原料的利用率
C. 工业生产硫酸的过程中使用过量的氧气,以提高二氧化硫的转化率
D. 氯气在饱和食盐水中的溶解度比在水中的小
难度: 中等查看答案及解析
-
常温下,下列溶液中各组离子一定能大量共存的是( )
A. 使甲基橙呈红色的溶液中:Na+、AlO2-、NO3—、Fe2+
B. 0.1 mol•L-1HCl溶液:Ba2+、K+、CH3COO-、NO3—
C. 0.1 mol•L-1 CO32-的溶液:Na+、Fe3+、NO
、SCN-
D. Kw/c(H+)=0.1 mol•L-1的溶液:Na+、K+、SO32-、NO3—
难度: 困难查看答案及解析
-
用下列装置进行实验,装置正确且能达到相应实验目的是
A. 析氢腐蚀
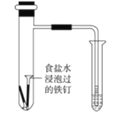 B. 证明二氧化氮生成四氧化二氮为放热反应
B. 证明二氧化氮生成四氧化二氮为放热反应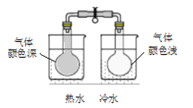 C. 测定溶液pH
C. 测定溶液pH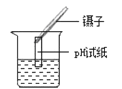 D. 测定盐酸浓度
D. 测定盐酸浓度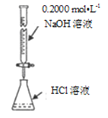
难度: 中等查看答案及解析
-
甲烷液化可获得工业原料甲醇,反应原理是:
①CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH1=+206.4 kJ·mol-1
②CO(g)+H2O(g)===CO2(g)+H2(g) ΔH2=-41.0 kJ·mol-1
③CO2(g)+3H2(g)===CH3OH(g)+H2O(g) ΔH3=-49.0 kJ·mol-1
下列说法不正确的是
A. 升高温度,反应①中CH4转化率提高
B. 反应③是CO2资源化利用的方法之一
C. CO(g)+2H2(g)===CH3OH(g) ΔH=-90.0 kJ·mol-1
D. 上述合成甲醇过程中需要向原料气中补充H2
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 钢铁腐蚀的负极反应:Fe – 3e- === Fe3+
B. HCO
的水解:HCO
+H2O
CO32-+H3O+
C. 用惰性电极电解饱和食盐水: 2Cl–+2H2O
H2↑+ Cl2↑+2OH–
D. AgCl悬浊液中加入KI溶液得到黄色沉淀:Ag+ + I- === AgI↓
难度: 困难查看答案及解析
-
某兴趣小组设计了如图所示原电池装置(盐桥中吸附有饱和K2SO4溶液)。下列说法正确的是
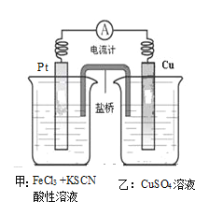
A. 该原电池的正极反应是Cu2++2e-===Cu
B. 甲烧杯中溶液的血红色逐渐变浅
C. 盐桥中的SO42-流向甲烧杯
D. Cu电极质量减少,Pt电极质量增加
难度: 中等查看答案及解析
-
某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。下列说法不正确的是
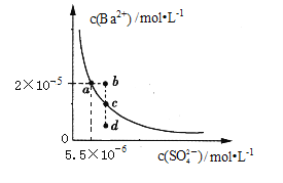
A. 加水稀释可以使溶液由c点变到d点
B. 此温度时,Ksp(BaSO4)=1.1×10-10
C. b点有BaSO4沉淀析出
D. a点对应的Ksp等于c点对应的Ksp
难度: 困难查看答案及解析
-
下列关于各图像的解释或结论正确的是
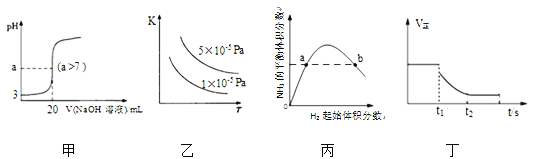
A. 图甲表示常温下向20mL pH=3的醋酸溶液中滴加pH=11的NaOH溶液,溶液的pH随NaOH溶液体积的变化关系
B. 图乙表示2SO2(g)+O2(g)
2SO3(g) △H<0的平衡常数K与温度和压强的关系
C. 图丙表示一定条件下的合成氨反应,N2的起始量恒定时,NH3的平衡体积分数随H2起始体积分数的变化,图中a点N2的转化率等于b点
D. 图丁表示反应 2SO2+O2
2SO3,t1 时刻降低温度符合图示变化
难度: 困难查看答案及解析
-
下列有关溶液中微粒的物质的量浓度关系不正确的是
A. NaHSO4溶液:c(H+)=c(SO42-) +c(OH-)
B. 在0.1 mol•L-1Na2CO3溶液中:c(OH-)-c(H+)=c(HCO3-)+2c(H2CO3)
C. 含等物质的量NaClO和Na2CO3的混合溶液中:c(HClO) + c(ClO-)=c(CO32-) +c(HCO3-)
D. 25℃时,浓度均为0.1 mol•L-1的NH3·H2O、NH4Cl混合溶液pH=9,则:c (NH4+)+ c (H+)>c (NH3·H2O)+ c (OH-)
难度: 困难查看答案及解析