-
化学与生产、生活、社会密切相关,下列有关说法不正确的是:
A.多用电子邮件、MSN、QQ等即时通讯工具,少用传真打印机属于“低碳生活”方式
B.我国神七宇航员所穿航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料
C.食品保鲜膜、一次性食品袋的主要成分是聚氯乙烯
D.用红外光谱仪可以确定物质中是否存在某些有机原子团
难度: 中等查看答案及解析
-
下列化学用语表示正确的是
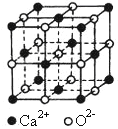
A.HClO的电子式为
B.硝基苯的结构简式为
C.饱和醇的通式CnH2n+2O
D.
 表示甲烷分子或四氯化碳分子的比例模型
表示甲烷分子或四氯化碳分子的比例模型难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值。下列叙述正确的是
A.CO和N2互为等电子体,22.4 L的CO气体与lmol N2所含的电子数相等
B.0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA
C.在铜与硫的反应中,1 mol铜参加反应失去的电子数目为NA
D.68 g的天然橡胶(聚异戊二烯)含有p键的数目为2 NA
难度: 中等查看答案及解析
-
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是
选项
物质转化关系
甲
乙
丙
丁
A.
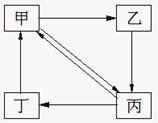
NO
HNO 3
NO2
NH3
B.
Na2CO3
NaOH
NaHCO3
CO2
C.
(NH4)2SO3
CaSO3
SO2
NH4HSO3
D.
Al(OH)3
Al2O3
NaAlO2
AlCl3
难度: 中等查看答案及解析
-
下列离子组一定能大量共存的是
A.遇苯酚显紫色的溶液中:I-、AlO2-、SCN-、Mg2+
B.使pH试纸变为蓝色的溶液中:Na+、C1-、S2-、ClO-
C.溶液中水电离产生的c(H+)、c(OH-)满足c(H+)·c(OH-)=10-24 :K+、NH4+、SO42-、NO3-
D.c(HCO3-)=0.1 mol/L的溶液中:NH4+、K+、SO32-、Br-
难度: 中等查看答案及解析
-
青石棉(cricidolite)是世界卫生组织确认的一种致癌物质。它的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是
A.青石棉的化学组成用氧化物的形式可表示为:Na2O·5FeO·8SiO2·H2O
B.该反应中氧化产物与还原产物的物质的量之比为3︰1
C.青石棉是一种易燃品,且易溶于水
D.适量Na2Fe5Si8O22(OH)2能完全溶于足量硝酸中,得到澄清透明溶液
难度: 中等查看答案及解析
-
某课外实验小组设计的下列实验合理的是
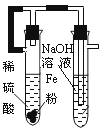
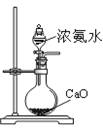

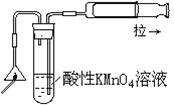
A.制备Fe(OH)2
B.制备少量氨气
C.实验室制备乙炔
D.检验火柴头燃烧产生的SO2
难度: 中等查看答案及解析
-
下列有关实验原理、操作及安全知识的叙述,正确的是
A.不慎将苯酚固体粉末沾在皮肤上,立即用大量热水(>65℃)冲洗
B.在用标准盐酸滴定未知浓度NaOH溶液时,滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失,会使测定结果偏低
C.把玻璃管插入橡胶塞孔时,可用厚布护手,紧握用水湿润的玻管,缓慢旋进塞孔中
D.银氨溶液、Cu(OH)2悬浊液、硫酸溶液、氯水在实验室里均不宜长期放置
难度: 中等查看答案及解析
-
2010年底欧盟通过一项禁令:2011年3月1日开始,含有双酚A的塑料被禁止用于儿童奶瓶的生产,因为它的结构类似雌性激素,可能影响内分泌和生殖系统。双酚A结构如图,下列说法,不正确的是
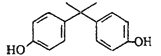
A.它既可以与FeCl3溶液发生反应,又可以与NaHCO3溶液反应
B.1mol该化合物最多消耗6mol H2
C.既可以和浓溴水生成沉淀,又可以使酸性KMnO4溶液褪色
D.它的分子式为C15H16O2
难度: 中等查看答案及解析
-
下列方程式正确的是
A.热化学方程式C2H2(g)+5/2O2(g)= 2CO2(g)+H2O(g)△H = -1256kJ/mol ,表示乙炔的燃烧热为1256 kJ/mol
B.高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+ 5C2O42- + 16H+ = 2Mn2+ + 10CO2↑+ 8H2O
C.在稀氨水中通入少量CO2:2NH3·H2O+CO2=2NH+CO2+H2O
D.用银氨溶液检验乙醛中的醛基:
CH3CHO+2[Ag(NH3)2]++2OH-
CH3COO-+NH4++3NH3+2Ag↓+H2O
难度: 中等查看答案及解析
-
常温下,有四种溶液:
①
②
③
④
0.1mol/L CH3COOH溶液
pH = 12
NaOH溶液
0.1mol/L
NaOH溶液
pH = 2
CH3COOH溶液
下列说法不正确的是
A.①稀释到原来的10倍后,pH与④相同
B.由水电离出的c(OH-):①>③
C.②与④混合,若溶液显酸性,则所得溶液中离子浓度可能为:
c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
D.①与③混合,若溶液pH = 7,则两溶液体积关系为:V(NaOH)=V(CH3COOH)
难度: 中等查看答案及解析
-
“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e- = X+2H+。下列说法中正确的是
A.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
B.电池内部H+由正极向负极移动
C.乙醇在负极发生反应,电流经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 中等查看答案及解析
-
A、B、C、D、E是原子序数逐渐增大的5种短周期元素,A与B组成的化合物BA4是具有温室效应的气体之一,B与D、C与D组成的化合物是机动车排出的大气污染物,D和E能形成原子个数比为1∶1和1∶2的两种离子化合物。下列说法不正确的是
A.B在元素周期表中的位置是第二周期IVA族
B.工业合成CA3的反应是放热反应,增大压强既能加快反应速率,又能提高原料转化率
C.气态氢化物的沸点:C>D
D.C和E组成的一种离子化合物,能与水反应生成两种碱
难度: 中等查看答案及解析
-
某可逆反应:a A(g)+b B(g) c C(g)+d D(g) △H = -Q kJ/mol(Q为正值),达平衡状态后,下列结论中不正确的是
A.若a+b=c+d,则往含有w mol气体的平衡体系中再加入w mol的B,达到新平衡时,气体的总物质的量等于2w mol
B.若平衡时,A、B 的转化率相等,说明反应开始时加入的A、B的物质的量之比为 a︰b
C.在相同条件下,两相同容器中分别加入amolA、bmolB和cmolC、dmolD,达到平衡状态后,前者放出热量Q1 kJ,后者吸收热量Q2 kJ,则Q1+ Q2 = Q
D.若温度不变,将容器的体积缩小到原来的一半,A的浓度为原来的1.9倍,则a+b<c+d
难度: 中等查看答案及解析
 请
请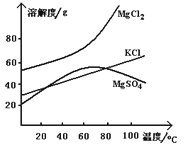
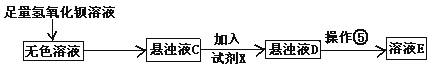
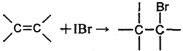 ② IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-
② IBr+KI=I2+KBr ③ I2+2S2O32-=2I-+S4O62-