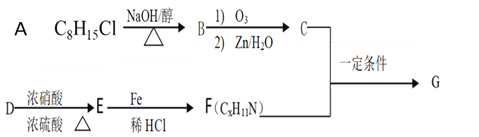
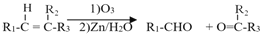-
化学无处不在,下列与化学有关的说法不正确的是( )
A. 酸性条件能加快漂白粉的杀菌消毒速率
B. PVC树脂、光导纤维及碳纤维都是有机高分子材料
C. 用锡焊接的铁质器件,焊接处容易生锈
D. 不法商家制取的“地沟油”无固定的熔沸点
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的值。下列说法正确的是()
A. 56g铁片投入足量浓硫酸中生成NA个SO2分子
B. 氢原子数为0.4NA的CH3OH分子中含有的σ键数为0.4NA
C. 1L 0.1mol/LNaHSO4溶液中含有HSO4—总数为0.1NA
D. 一定条件下,向恒容容器中充入3molH2(g)和1molN2(g)发生反应,N2(g)+3H2(g)
2NH3(g)△H= - Q KJ/mol, 当该反应放出0.25 QKJ的热量时,容器中的氢分子数共有2.25 NA
难度: 中等查看答案及解析
-
药物麻黄碱和牛磺酸的结构简式如图。有关麻黄碱、牛磺酸的叙述正确的是
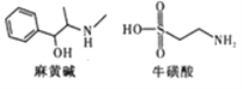
A. 分子式分别为 C10H16ON、C2H7NO2S
B. 均能与金属钠及氢氧化钠溶液反应
C. 均能发生取代反应,麻黄碱还能发生加成反应
D. 牛磺酸与HSCH2CH( NH2)COOH( 半胱氨酸) 互为同系物
难度: 中等查看答案及解析
-
下列相关实验的说法正确的是
A. 用酒精灯将MgSO4溶液蒸干、灼烧至恒重,最终剩余固体是MgO
B. 向NaAlO2溶液中滴入NaHCO3溶液可析出Al(OH)3沉淀,说明AlO2-结合质子的能力比CO32-强
C. 向废铁屑溶于浓盐酸所得溶液中加人酸性KMnO4溶液,紫色褪去说明溶液中含有Fe2+
D. 将铂丝用硫酸洗净后,在外焰上灼烧至没有颜色,再蘸取碳酸钾灼烧,可直接观察到火焰呈紫色
难度: 中等查看答案及解析
-
下表各组物质之间不能通过一步反应实现如图所示转化关系的是

选项
X
Y
Z
对应箭头上所标数字的反应试剂
A
Fe
FeCl3
FeCl2
①④可用相同试剂
B
Al2O3
NaAlO2
Al(OH)3
②加氨水
C
NO
NO2
HNO3
②气体通入水中
D
Cl2
HClO
NaClO
③加浓盐酸
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
某温度下,已知醋酸的电离常数Ka= 1.6×10-5,醋酸银的溶度积Ksp(CH3COOAg)= 3.7×10-3。下列有关说法正确的是
A. 醋酸溶液中,c(CH3COO-)>c( H+)>c(OH-)
B. 将相同浓度的CH3COOH 溶液与CH3COO Na 溶液等体积混合,所得溶液呈碱性
C. 该温度下,1mol/L的醋酸溶液中,醋酸的电离度为0.4%
D. 该温度下,浓度均为0.02mol/L的CH3COONa溶液和AgNO3溶液等体积混合(忽略混合后溶液体积的变化),有CH3COOAg 沉淀生成
难度: 困难查看答案及解析
-
常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
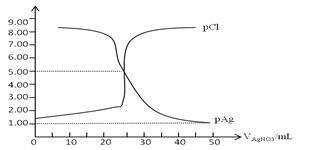
A. AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B. 为防止指示剂失效,溶液应维持中性或弱碱性
C. 滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D. 滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
难度: 困难查看答案及解析
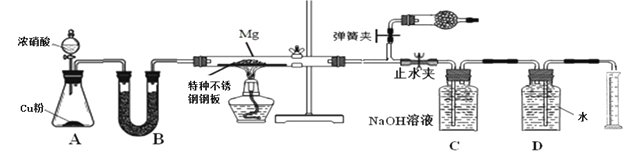
 Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。
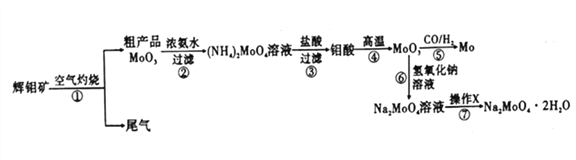
Lix(MoS2)n[Lix(MoS2)n附着在电极上],则电池充电时阳极的电极反应式为___________________。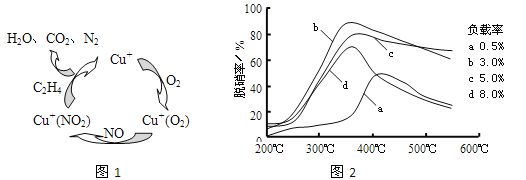
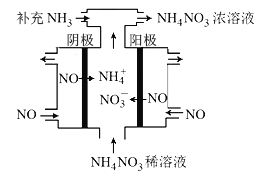
 。
。