-
化学与生产生活密切相关。下列有关说法正确的是( )
A. 食品包装袋内放置铁粉与放置硅酸干凝胶的作用相同
B. 以地沟油为原料生产的生物柴油与以石油为原料生产的柴油化学成分相似
C. 工业生产玻璃和高炉炼铁均需用到石灰石
D. 氯气用于自来水消毒杀菌与医用酒精用于皮肤表面消毒杀菌原理相似
难度: 简单查看答案及解析
-
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A. 在含CO32-总数为NA的Na2CO3溶液中,Na+总数为2NA
B. 标准状况下,2.24 L乙烷和丙烯的混合物中含氢原子数目为0.6NA
C. 将0.1 mol H2和0.2 mol I2(g)充入密闭容器中充分反应后,生成的H-I键数目为0.2NA
D. 常温下,电解1 L的精制食盐水,一段时间后测得溶液pH为11,则电解过程中通过导线的电子数目为0.002NA
难度: 中等查看答案及解析
-
有机化合物M、N的结构如图所示。
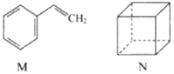 下列有关说法不正确的是( )
下列有关说法不正确的是( )A. 两者互为同分异构体 B. M能使Br2的四氯化碳溶液褪色
C. N的二氯代物有3种不同结构 D. M中所有原子不可能共平面
难度: 中等查看答案及解析
-
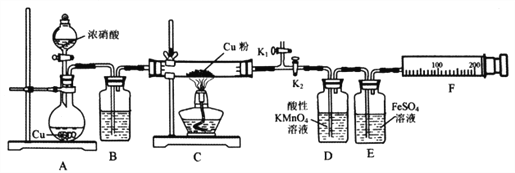
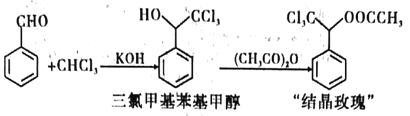
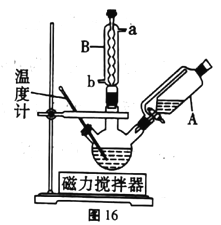
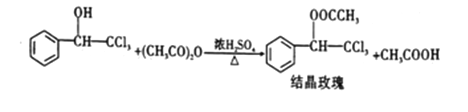
下列实验方案能达到相应实验目的的是( )
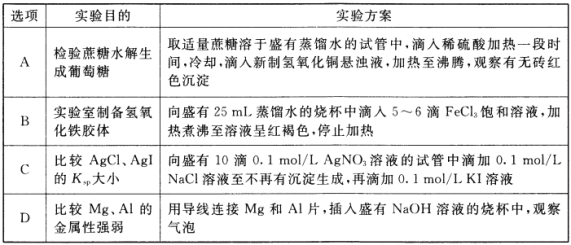
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于实验操作的说法正确的是( )
A. 用苯萃取溴水中的溴时,将溴的苯溶液从分液漏斗下口放出
B. 中和滴定实验中,锥形瓶用蒸馏水洗净须经烘箱烘干后才可使用
C. 配制0.5mol·L-1480mL的NaOH溶液需称量9.6 g NaOH固体
D. 某溶液中滴入2滴K3[Fe(CN)6]溶液生成具有特征蓝色的沉淀,说明原溶液中含有Fe2+
难度: 简单查看答案及解析
-
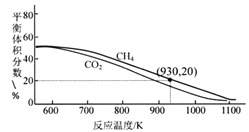
双极膜(BP)是阴、阳复合膜,在直流电的作用下,阴、阳膜复合层间的H2O解离成H+和OH-,作为H+和OH-离子源。利用双极膜电渗析法电解食盐水可获得淡水、NaOH和HCl,其工作原理如图所示,M、N为离子交换膜。下列说法错误的是( )
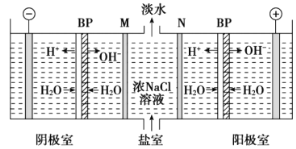
A. 阴极室发生的反应为2H++2e-=H2↑
B. M为阳离子交换膜,N为阴离子交换膜
C. 若去掉双极膜(BP),阳极室会有Cl2生成
D. 电路中每转移1mol电子,两极共得到0.5mol气体
难度: 困难查看答案及解析
-
若用AG表示溶液的酸度,其表达式为:AG=lg[
]。室温下,实验室里用0.10mol/L的盐酸溶液滴定10 mL 0.10 mol/L MOH溶液,滴定曲线如图所示:下列说法正确的是( )
A. 该滴定过程可选择酚酞作为指示剂
B. C点加入盐酸的体积为10mL
C. 若B点加入的盐酸溶液体积为5mL,所得溶液中:c(M+)+2c(H+)=c(MOH)+2c(OH−)
D. 滴定过程中从A点到D点溶液中水的电离程度逐渐增大
难度: 困难查看答案及解析