-
资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);Cu2O+2H+=Cu+Cu2++H2O
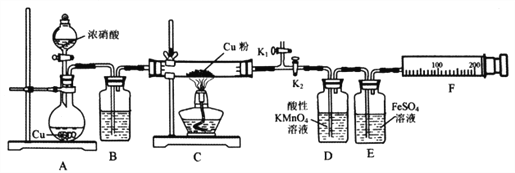
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是__________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
| C装置质量 | F装置气体的体积(已折算为标准状况) |
| 玻管质量 | Cu质量 | 反应后(玻管+生成物) |
| mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
-
资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
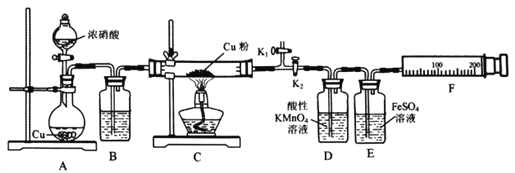
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
| C装置质量 | F装置气体的体积(已折算为标准状况) |
| 玻管质量 | Cu质量 | 反应后(玻管+生成物) |
| mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
-
资料表明:赤热铜能与NO2反应。某小组设计了如下实验装置进行探究,探究固体产物的成分,气体产物是N2还是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反应:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
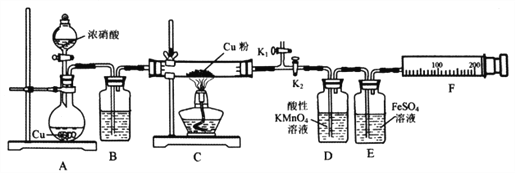
请回答下列问题:
(1)A中反应的化学方程式为________________________。
(2)检查装置气密性,装好药品,然后实验的正确操作顺序是____________
①关闭K1,打开K2 ②打开分液漏斗活塞
③打开K1,关闭K2 ④点燃C处酒精灯
(3)实验过程中,D装置中的现象是____________,能否根据D装置中的现象确认C中有无NO生成? ______,理由是________________________。
(4)E装置的作用是____________。
(5)当铜粉完全反应后,实验小组对反应后的固体成分提出以下猜想:①只有CuO;②只有Cu2O;有同学认为可通过简单的定性实验即可判断猜想①是否成立,其实验方法是_____________________。
(6)实验中E装置自始至终未显棕色,小组最后通过定量实验得到如下数据。
| C装置质量 | F装置气体的体积(已折算为标准状况) |
| 玻管质量 | Cu质量 | 反应后(玻管+生成物) |
| mg | 1.92g | (m+2.24)g | 112mL |
据此写出实验时实际发生反应的化学方程式________________________。
-
硝酸与金属反应时,浓度不同生成的还原产物也可能不同。某兴趣小组进行了如下实验探究。
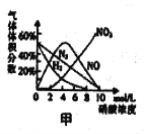
[查阅资料]
a.镁与硝酸反应生成各气体产物成分及含量随HNO3浓度变化曲线如图甲所示:
b.NO2沸点:21℃;NO沸点:-151℃
c.2NO2+2OH-=NO3-+NO2-+H2O,NO+NO2+2OH-=2NO2-+H2O
[实验探究] 该小组拟选用如图A B C D所示装置探究镁与4 mol·L-1硝酸反应的产物。连接装置A→B→C→D→C,检查气密性,按图示加入试剂,D中通入的O2微过量。
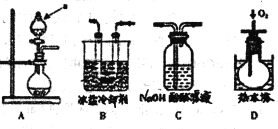
(1)后一个C装置的作用是_______,证明气体产物中有NO生成的实验现象是______。
(2)从第一个C装置中逸出的气体成分是________。
(3)溶液中还可能有一种还原产物,这种还原产物可能是_____,请设计实验验证你的猜想________;并写出生成该还原产物的化学方程式_____________
-
某实验小组设计了如下装置对焦炭还原二氧化硅的气体产物的成分进行探究。
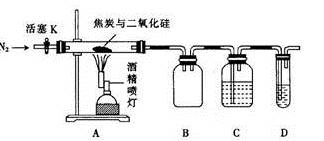
已知:PdCl2溶液可用于检验CO,反应的化学方程式为CO + PdCl2 + H2O = CO2 + 2HCl + Pd↓
(产生黑色金属钯粉末,使溶液变浑浊)。
(1)实验时要通入足够长时间的N2,其原因是_ 。
(2)装置B的作用是_ 。
(3)装置C、D中所盛试剂分别为_ ___ 、_ ___ ,若装置C、D中溶液均变浑浊,且经检测两气体产物的物质的量相等,则该反应的化学方程式为_ 。
(4)该装置的缺点是_ 。
(5)资料表明,上述反应在焦炭过量时会生成副产物SiC。取18 g SiO2和8.4 g焦炭充分反应后收集到标准状况下的气体13.44 L,假定气体产物只有CO,固体产物只有Si和SiC,则Si和SiC的物质的量之比为_ 。
(6)设计实验证明碳酸的酸性比硅酸的强:_ 。
-
(15分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
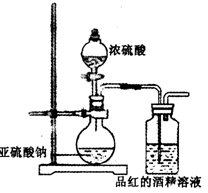
(1)为了探究干燥的SO2能不能使品红褪色,某同学设
计了如右图所示实验装置,请指出实验装置图设计中的
不合理之处。
①________;
②________。
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导致。为此,SO2能使品红的水溶液褪色的可能微粒有________。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品红褪色的微粒是HSO—3和SO32-,不是H2SO3。你认为他的结论是否正确____,其理由是________。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml。于两只小烧杯中,两只烧杯中同时一次性各加入20mL 0.1mol/L的亚硫酸钠,20mL 0.1mol/L的亚硫酸氢钠溶液,发现加人亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“____”内容。
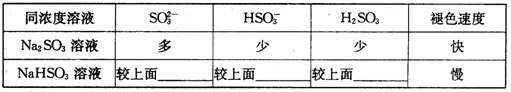
②根据实验和分析,该同学得出的结论是.
-
(16分)已知氯气的漂白作用实际上是氯气与水反应生成的次氯酸的漂白作用。为了探究二氧化硫的漂白作用到底是二氧化硫本身还是二氧化硫与水作用的产物,某学习小组设计了如下装置来进行实验。请回答相关问题。
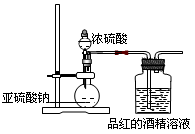
(1)为了探究干燥的SO2能不能使品红褪色,某同学设计了如图所示实验装置,请指出实验装置图设计中的不合理之处。
①; ②________.
(2)按照修改后的装置,实验中控制二氧化硫以大约每秒3个气泡的速度通过品红的酒
精溶液时,经过一小时后,品红仍不褪色。这说明品红褪色的原因不是二氧化硫直接导
致。为此,SO2能使品红的水溶液褪色的可能微粒有________。
(3)甲同学实验如下:取等量、相同浓度的品红水溶液于两支试管中,再分别加入少量
亚硫酸钠固体和亚硫酸氢钠固体,两支试管中的品红都褪色,对此,他得出结论:使品
红褪色的微粒是HSO3-和SO32-,不是H2SO3。你认为他的结论是否正确________,其理由
是________。
(4)为了进一步探究,乙组同学做了如下实验:分别取相同浓度的品红水溶液各20ml于两只小烧杯中,两只烧杯中同时一次性各加入20ml 0.1mol/L的亚硫酸钠,20ml 0.1mol/L的亚硫酸氢钠溶液,发现加入亚硫酸钠溶液的品红褪色较快。
①微粒浓度与褪色快慢关系,请用“多”或“少”填写“________”内容。
| 同浓度溶液 | SO32- | HSO3- | H2SO3 | 褪色速度 |
| Na2SO3溶液 | 多 | 少 | 少 | 快 |
| NaHSO3溶液 | 较上面________ | 较上面________ | 较上面________ | 慢 |
②根据实验和分析,得出的结论是________。
-
某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
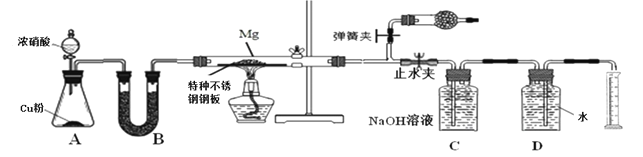
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
-
某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
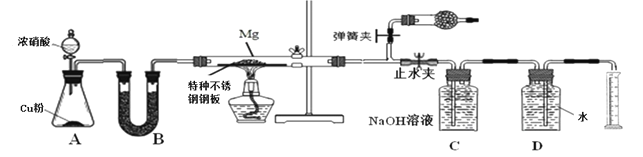
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________
-
某课外活动小组根据镁与CO2的反应设计实验探究镁与NO2的反应。
甲同学推测产物是MgO和N2;
乙同学推测产物除了MgO和N2外,固体中还可能含有Y。
该小组同学设计了以下装置探究镁与NO2反应的固体产物,并测定其组成。
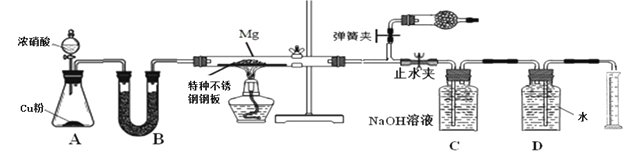
(1)实验开始时,先关闭止水夹后打开弹簧夹,再打开分液漏斗活塞,当硬质玻璃管充满红综色气体后,打开止水夹,关闭弹簧夹,最后点燃酒精灯。这样做的目的是___________________________________________________________
(2)装置B中的试剂可以选用________
A、浓硫酸 B、无水氯化钙 C、五氧化二磷 D、碱石灰
(3)装置C中盛装氢氧化钠溶液的作用是:___________________________________
(4)为保证生成气体体积的准确性,读取量筒刻度时应注意的问题是①气体恢复至室温再读数;②_______________________________;③______________________________。
(5)实验结束后,同学们将固体产物取出与水反应,发现有刺激性气味的气体产生,该气体能使湿润的石蕊试纸变蓝。说明乙组同学推测正确,请写出Y与水反应的化学方程式__________________________________
(6)若初始加入镁粉质量为3.6 g,在足量的NO2中充分反应后 ,收集到N2体积为448mL (标准状况),则产物中MgO的质量是_________











