-
[化学一-选修3:物质结构与性质]由S、Cl 及Fe、Co、Ni 等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为________,P、S、Cl的第一电离能由大到小顺序为______。
(2)SCl2 分子中的中心原子杂化轨道类型是______,该分子空间构型为_______。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni 与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为_______,Ni(CO)4为____晶 体。
(4)已知NiO的晶体结构如图1所示。
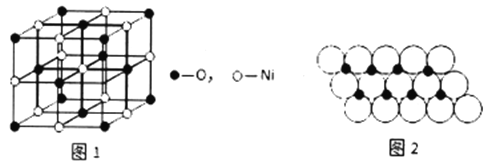
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO 晶体中镍原子填充在氧原子形成的______体空隙中。
②已知MgO 与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm 和69pm。则熔点:MgO_____ NiO( 填“ >”、“ <" 或“ =” ), 理由是______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为am,每平方米面积上分散的NiO的质量为_________g。(用a、NA表示)
-
(化学-选修3:物质结构与性质)
由S、Cl及Fe、Co、Ni 等过渡元素组成的新型材料有着广泛的用途,回答下列问题:
(1)钴元素基态原子的电子排布式为____,P、S、C1的第一电离能由大到小顺序为______。
(2)SCl2分子中的中心原子杂化轨道类型是_______,该分子空间构型为________。
(3)Fe、Co、Ni等过渡元素易与CO形成配合物,化学式遵循18电子规则:中心原子的价电子数加上配体提供的电子数之和等于18,如Ni与CO形成配合物化学式为Ni(CO)4,则Fe与CO形成配合物化学式为_______。Ni(CO)4中σ键与π键个数比为______,已知:Ni(CO)4熔点-19.3℃,沸点43℃,则Ni(CO)4为_______晶体。
(4)已知NiO的晶体结构如图所示。
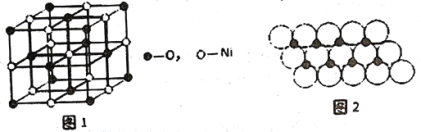
①NiO的晶体结构可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中。则NiO晶体中镍原子填充在氧原子形成的___体空隙中。
②已知MgO与NiO的晶体结构相同,其中Mg2+和Ni2+的离子半径分别为66pm和69pm。则熔点:MgO____NiO( 填“ >”、“<”或“=”),理由是_______________。
③一定温度下,NiO晶体可以自发地分散并形成“单分子层”,可以认为O2-作密置单层排列,Ni2+填充O2-形成的正三角形空隙中(如图),己知O2-的半径为am,每平方米面积上分散的NiO的质量为______g。(用a、NA表示)
-
【化学—选修3:物质结构与性质】铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1)铜元素基态原子的价电子排布式________。
(2)铜能形成多种配合物,如Cu2+与乙二胺(H2N-CH2-CH2-NH2)可形成如图所示配离子。
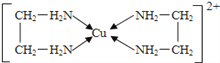
①Cu2+与乙二胺所形成的配离子中含有的化学键是________。
a.配位键 b.离子键 c.  键 d.
键 d.  键
键
②乙二胺分子中氮原子的杂化轨道类型为________,C、N、H三种元素的电负性由大到小顺序是________。
③乙二胺和三甲胺[N(CH3)3]均属于胺,乙二胺的沸点比三甲胺高很多,原因是________。
(3)Cu2+在水溶液中以[Cu(H2O)4]2+形式存在,向含Cu2+的溶液中加入足量氨水,可生成更稳定的[Cu(NH3)4]2+,其原因是________。
(4)Cu和S形成某种晶体的晶胞如图所示。
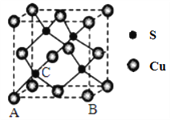
①该晶体的化学式为________。
②该晶胞原子坐标参数A为(0,0,0);B为(1,0,0)。则C原子的坐标参数为________。
③已知该晶体的密度为d g·cm-3,Cu2+和S2-的半径分别为a pm和b pm,阿伏加德罗常数值为NA。列式表示该晶体中原子的空间利用率________。
-
【化学-选修3 物质结构与性质】
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置 。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______(填晶体类型).Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=______ 。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s) Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 、 。
Fe(s)+ xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有 、 。
(3)k3[Fe(CN)6]溶液可用于检验 (填离子符号)。CN-中碳原子杂化轨道类型为 ,C、N、O三元素的第一电离能由大到小的顺序为 (用元素符号表示)。
(4)铜晶体铜碳原子的堆积方式如图所示。

①基态铜原子的核外电子排布式为 。
②每个铜原子周围距离最近的铜原子数目 。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如图所示(黑点代表铜原子)。

①该晶体的化学式为 。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 (填“离子”、“共价”)化合物。
③已知该晶体的密度为ρg.cm-3,阿伏伽德罗常数为NA,
则该晶体中铜原子和M原子之间的最短距离为 pm(只写计算式)。
-
【化学一选修3:物质结构与性质】由N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态Ni原子的最外层电子排布式为_____________________。
(2)化合物A(H3BNH3)是一种潜在的储氢材料,它可由六元环状化合物(HB=NH)3通过
3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3制得。
①与上述化学方程式有关的叙述不正确的是_________。(填标号)
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个(HB=NH)3分子中有__________个 键。
键。
(3)立方氮化硼结构和硬度都与金刚石相似,但熔点比金刚石低,原因是__________。右图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。
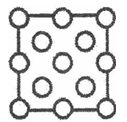
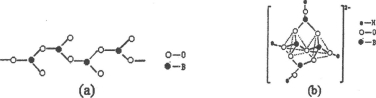
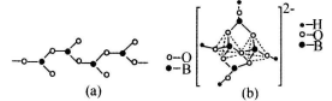
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为________,图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。

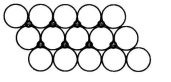
(5)在一定温度下,NiO晶体可以自发地分散并形成“单分子层”(如右图),可以认为氧离子作密置单层排列,镍离子填充其中,氧离子的半径为a pm,则每平方米面积上分散的该晶体的质量为_________g(用a、NA表示)
-
【化学选修3:物质结构与性质】铝、铁在生活、生产中有着广泛的用途,请回答下列问题。
(1)Fe2+的最外层电子排布式____________。元素Fe与Mn的第三电离能分别为I3(Fe)、I3(Mn),则I3(Fe)______I3(Mn)(填“>”、“<")。
(2)第四周期中,与Al原子未成对电子数相同的金属元素有____种。气态氯化铝的分子组成为(AlCl3)2,其中Al、Cl均达8e-稳定结构,Al原子的杂化方式为__________。根据等电子原理,AlO2-的空间构型为_____。
(3)Fe(CO)5的熔点为-20℃,沸点为103℃,易溶于乙醚,其晶体类型为______,晶体中σ键和π键的数目之比为______。
(4)科学家们发现某些含铁的物质可催化尿素合成肼(N2H4),沸点:N2H4>C2H6的主要原因为____________。
(5)FeO晶体的晶胞如图所示,己知:FeO晶体的密度为ρg/cm3,NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为_____;Fe2+与O2-最短核间距为______pm(用ρ和NA表示)。

-
【化学——选修3 物质结构与性质】
铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置为_________________________。
(2)配合物Fe(CO)x常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于______________(填晶体类型)。Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=____________。Fe(CO)x在一定条件下发生反应:Fe(CO)x(s)=Fe(s)+xCO(g)。已知反应过程中只断裂配位键,则该反应生成物含有的化学键类型有_______________、_____________。
(3)K3[Fe(CN)6]溶液可用于检验___________(填离子符号)。CN-中碳原子杂化轨道类型为__________,C、N、O三元素的第一电离能由大到小的顺序为__________(用元素符号表示)。
(4)铜晶体铜碳原子的堆积方式如右图所示。

①基态铜原子的核外电子排布式为____________________。
②每个铜原子周围距离最近的铜原子数目___________________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子,空心圆代表M原子)。
①该晶体的化学式为_________________。
②已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于____________(填“离子”或“共价”)化合物。
③已知该晶体的密度为ρ g·cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子与M原子之间的最短距离为_______________pm(只写计算式)。
-
[化学——选修3:物质结构与性质](15分)
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对应的辐射波长为_______nm(填标号)。
A.404.4 B.553.5 C.589.2 D.670.8 E.766.5
(2)基态K原子中,核外电子占据的最高能层的符号是_________,占据该能层电子的电子云轮廓图形状为___________。K和Cr属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Cr低,原因是___________________________。
(3)X射线衍射测定等发现,I3AsF6中存在I3+离子。I3+离子的几何构型为_____________,中心原子的杂化形式为________________。
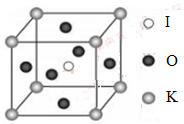
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立体结构,边长为a=0.446nm,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示。K与O间的最短距离为______nm,与K紧邻的O个数为__________。
(5)在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于______位置,O处于______位置。
-
[化学一选修3:物质结构与性质]
钾和碘的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)元素K的焰色反应呈紫红色,其中紫色对立的辐射波长为_____________nm(填序号)。
A.589.2 B.500.3 C.650.2 D.434.4
(2) K和Fe属于同一周期,且核外最外层电子构型相同,但金属K的熔点、沸点等都比金属Fe低,原因是________________________。
(3) 基态I原子中,核外电子占据最高能层的符号为_____________________。
(4)KIO3晶体是一种性能良好的非线性光学材料,具有钙钛矿型的立方结构,边长a=0.446am,晶胞中K、I、O分别处于顶角、体心、面心位置,如图所示,K 与O间的最短距离为________nm,与K紧邻的O 个数为_____________________。
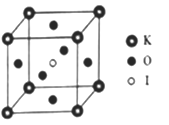
(5) 在KIO3晶胞结构的另一种表示中,I处于各顶角位置,则K处于________位置,O处于__________位置。
-
选考[化学——物质结构与性质](15分)由Cu、N、B、Ni等元素组成的新型材料有着广泛用途。
(1)基态 Cu+的最外层核外电子排布式为_________.
(2)研究者预想合成一个纯粹由氮组成的新物种 N5+N3-,若N5+ 离子中每个氮原子均满足8电子结构,以下有关N5+ 推测正确的是 ( )
A.N5+有24个电子
B.N5+离子中存在三对未成键的电子对
C.N5+阳离子中存在两个氮氮三键
(3)化合物  是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物  。通过
。通过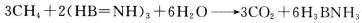 制得。
制得。
①与上述化学方程式有关的叙述不正确的是_________(填标号)。
A.反应前后碳原子的轨道杂化类型不变
B.CH4、H2O、CO2分子空间构型分别是:正四面体形、V形、直线形
C.第一电离能:N>O>C>B
D.化合物A中存在配位键
②1个 分子中有_________个
分子中有_________个 键。
键。
(4)在硼酸盐中,阴离子有链状、环状等多种结构形式。图(a)是一种链状结构的多硼酸根,则多硼酸根离子符号为_________图(b)是硼砂晶体中阴离子的环状结构,其中硼原子采取的杂化类型为_________。
(5)NiO晶体结构与NaCl晶体类似,其晶胞的棱长为acm,则该晶体中距离最近的两个阳离子核间的距离为_________(用含有a的代数式表示)。在一定温度下,Ni0晶体可以自发地分散并形成“单分子层”(如图),可以认为氧离子作密致单层排列,镍离子填充其中,列式并计算每平方米面积上分散的该晶体的质量为_________g(氧离子的半径为1. 40×10 m,
m,  ≈l. 732)。
≈l. 732)。
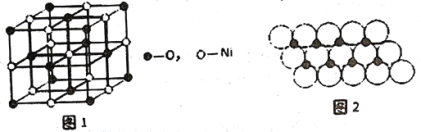













 是一种潜在的储氢材料,它可由六元环状化合物
是一种潜在的储氢材料,它可由六元环状化合物 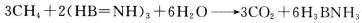 制得。
制得。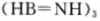 分子中有_________个
分子中有_________个
