-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是KOH
B. 高铁“复兴号”车厢连接关键部位使用的増强聚四氟乙烯板属于无机髙分子材料
C. 泡沫灭火器中的Al2(SO4)3溶液应贮存在铁制内筒中
D. 用“静电除尘”、“燃煤固硫”“汽车尾气催化净化”等方法,可提髙空气质量
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 1molAlCl3在熔融状态吋含有的离子总数为0.4NA
B. 某温度下纯水的pH=6,该温度下10LpH=11的NaOH溶液中含OH-的数目为NA
C. 8.7g二氧化锰与含有0.4molHCl的浓盐酸加热充分反应,转移电子的数目为0.2NA
D. 12g金刚石中C-C键的数目为4NA
难度: 中等查看答案及解析
-
关于有机物(
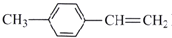 )的结构、性质有关的叙述正确的是
)的结构、性质有关的叙述正确的是A. 该物质所有原子可能在同一平面
B. 与该物质具有相同官能团的芳香烃同分异构体有2种
C. 该物质在一定条件下能发生加成反应、氧化反应、取代反应、加聚反应
D. 1mol该物质最多可与1moBr2反应
难度: 简单查看答案及解析
-
下列有关实验操作,实验现象以及解释或结论都正确的是
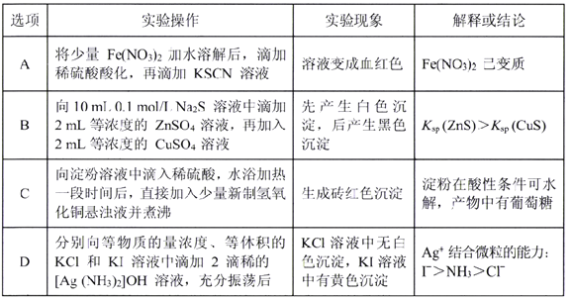
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下图是一种已投入生产的大型蓄电系统。电解质通过泵不断地在储罐和电池间循环;电池中间为离子选择性膜,在电池放电和充电时该膜可允许钠离子通过;图中左边的电解质为Na2S2、Na2S4,右边电解质为NaBr3、NaBr。充、放电时发生的反应为:Na2S4+3NaBr
2Na2S2+NaBr3,下列说法正确的是
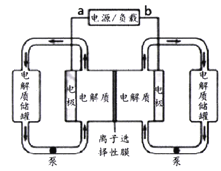
A. 充电时b端为电源负极
B. 在放电过程中钠离子通过离子选择膜的流向为从右到左
C. 电池充电时,阴极的电极反应为S42-+2e-=2S22-
D. 以此蓄电池为电源电解精炼铜,当有0.1 mol e-转移吋时,阳极有3.2g铜溶解
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、M、W的原子序数依次增大,其中Z、W处于同一主族,Z、M的原子最外层电子数之和等于9,Y的氢化物常温下呈液态,是人类生存的重要资源,X的简单氢化物与W的单质(黄绿色)组成的混合气体见光可生成W的氢化物和油状混合物。下列说法正确的是
A. Y和W形成的某种二元化合物可用于自来水的杀菌消毒
B. 简单离子半径:Y<M<W
C. W的氧化物对应的水化物的酸性比X的强
D. Z分别与X、M形成的化合物,其所含化学键的类型相同
难度: 中等查看答案及解析
-
已知H3PO4是一种三元中强酸。25℃时,某浓度H3PO4溶液中逐滴加入NaOH溶液,滴加过程中各种含磷微粒的物质的量分数δ随溶液pH的变化曲线如下图所示。下列说法正确的是
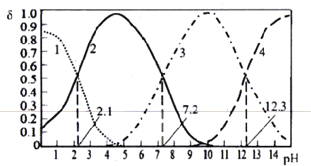
A. 曲线2和曲线4分别表示δ(HPO42-)和δ(PO43-)变化
B. 25℃时,H3PO4的电离常数K1:K2=105.1
C. pH=7.2时,溶液中由水电离出的c(H+)=10-7.2mol/L
D. pH=12.3时,溶液中2c(Na+)=5c(H2PO4-)+5c(HPO42-)+5c(PO43-)+5c(H3PO4)
难度: 中等查看答案及解析
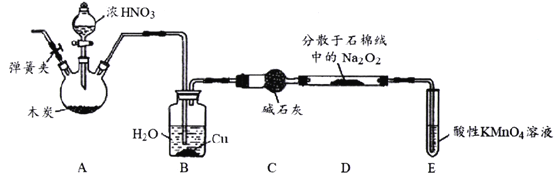
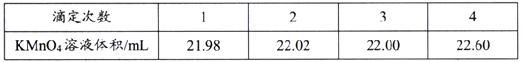
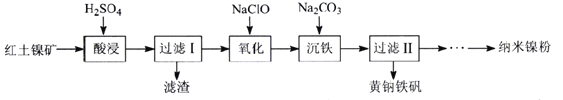
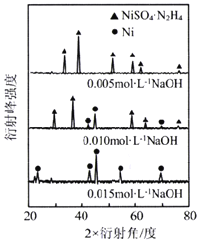
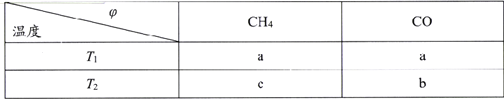
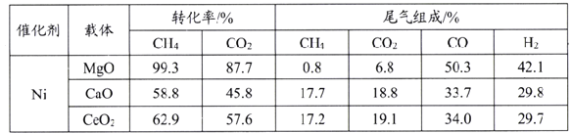
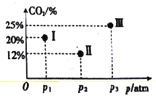
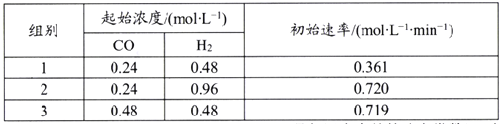
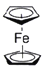 。环戊二烯分子(
。环戊二烯分子(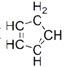 )中碳原子的杂化方式为_______。
)中碳原子的杂化方式为_______。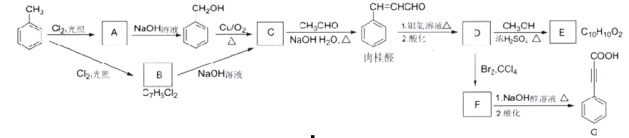
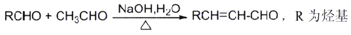
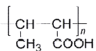 的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______
的合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件,无机试剂任选)______