-
化学与社会、生活密切相关。对下列现象或事实的解释不正确的是( )
选项
现象或事实
解释
A
漂白粉在空气中久置变质
漂白粉中的
与空气中的
反应生成
B
纸浆、草帽用
漂白
具有漂白性
C
漂白粉漂白织物
次氯酸具有氧化性
D
氢氟酸在玻璃器皿上刻蚀标记
HF与
反应
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列关于氯及其化合物的说法正确的是( )
A.
具有很强的氧化性,在化学反应中只能作氧化剂
B. 氢气在氯气中燃烧,瓶口出现白雾
C. 新制氯水或液氯都能使干燥的有色布条褪色
D. Fe在
中的燃烧产物用数轴表示如下:
难度: 中等查看答案及解析
-
下列各组离子加入试剂后仍能大量存在的是( )
A. 滴加稀硫酸酸化后:
、
、
、NO3-
B. 滴加新制氯水后:
、
、
、
、
C. 滴加浓盐酸酸化后:
、
、
、NO3-
D. 滴加酚酞显红色:
、
、
、
难度: 中等查看答案及解析
-
亚硝酸钠(
)是一种具有咸味、有毒、具有防腐性,且价格比食盐(
)便宜的工业用盐,常被误作食盐使用,导致多起中毒事故发生,它的部分性质如右图,下列说法错误的是( )
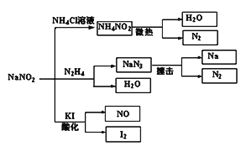
A. 可用淀粉碘化钾试纸和食醋鉴别食盐(
)与亚硝酸钠(
)
B. 亚硝酸钠可以加到食品中,但添加量要符合规定
C.
与
反应生成
的化学方程式为
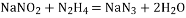
D. 上图所涉及的化学反应都是氧化还原反应
难度: 困难查看答案及解析
-
以下有关氨及铵盐的叙述中不正确的是( )
A. 大多数铵盐都易溶于水,但不是所有铵盐中的氮均呈-3价
B. 氨的喷泉实验体现了氨的溶解性和氧化性
C. 实验室里常用固体氯化铵与氢氧化钙反应制取少量氨气
D. 氨具有还原性,一定条件下可与氧化性的物质如氧气发生反应
难度: 中等查看答案及解析
-
下列关于硫及其化合物的说法中,正确的是( )
A. 硫是一种易溶于水的淡黄色晶体
B. 将
通入硝酸酸化的
溶液中,有白色沉淀生成,再加盐酸后沉淀消失
C. 除去
中混有的
、HCl气体可以选用饱和的
溶液
D. 浓硫酸、浓硝酸、稀硝酸都是氧化性酸,常温下都能使金属铁、铝钝化
难度: 中等查看答案及解析
-
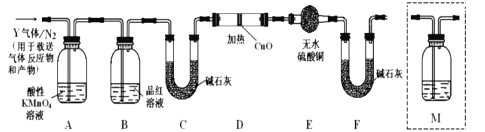
某研究性学习小组的同学利用MnO2和浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置(数量可满足需要,不含制气装置)如下,下列说法正确的是( )
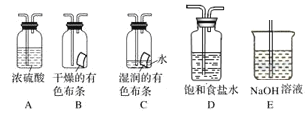
A. 装置E中发生反应的离子方程式为:Cl2+OH-=Cl-+ClO-+H2O
B. 按气流流动的先后顺序,装置连接顺序依次为DABAE
C. 装置E的主要用途是制备NaClO
D. 装置D的作用是除去氯气中的HCl并提供水蒸气以验证HClO具有漂白性
难度: 中等查看答案及解析
-
下列实验现象所对应的离子方程式不正确的是( )
选项
实验
现象
离子方程式
A
将稀硫酸滴加到KI淀粉溶液中
在空气中放置一段时间后溶液呈蓝色
B
用硫氰化钾溶液检验某溶液中含有
溶液变成红色
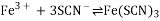
C
酸性
溶液中加入
溶液
溶液紫色褪去
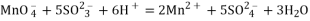
D
将
通入漂白粉溶液
有白色沉淀生成
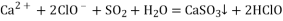
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
有a、b、c、d、e五种气体,现进行下列实验:
(1)a和b混合
气体变红棕色
(2)c和d混合
产生白烟
(3)c和e分别通入少量溴水中
溴水都变成无色透明的液体
(4)b和e分别通入氢硫酸中
都产生淡黄色浑浊
则a、b、c、d、e依次可能是( )
A.
、
、HCl、
、
B.
、
、
、HCl、
C.
、
、
、HCl、
D. HCl、
、
、
、
难度: 困难查看答案及解析
-
下列现象或事实可用同一原理解释的是( )
A. 浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.
能使溴水和品红溶液褪色
C.
和
溶液使酸性高锰酸钾溶液的紫色褪去
D. 新制的氨水、氯水放置时间较久而变质
难度: 中等查看答案及解析
-
如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( )
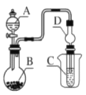
A. 若A为浓硫酸,B为
固体,C中盛石蕊溶液,则C中溶液先变红后褪色
B. 若A为醋酸溶液,B为石灰石,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓盐酸,B为
,C中盛品红溶液,则C中溶液不褪色
D. 若A为浓氨水,B为生石灰,C中盛
溶液,则C中产生白色沉淀
难度: 困难查看答案及解析
-
下列除杂方案错误的是( )
选项
被提纯的物质
杂质
除杂试剂
除杂方法
A
(g)
(g)
酸性
溶液、浓
洗气
B
(aq)
(aq)
NaOH溶液
过滤
C
(g)
HCl(g)
饱和食盐水、浓
洗气
D
(s)
(s)
—
灼烧
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
对下列事实的解释正确的是( )
A. 蘸有浓硫酸和蘸有浓氨水的玻璃棒靠近没有白烟,说明硫酸与氨气不反应
B. 医疗上可用硫酸钡作X射线透视肠胃的内服药,是因为硫酸钡不溶于酸
C.
是还原性气体,浓
是强氧化性物质,因此
不能用浓
作干燥剂
D. 常温下,浓
可以用铝制容器贮存,说明铝与浓硝酸不反应
难度: 中等查看答案及解析
-
设
表示阿伏加德罗常数的值,下列叙述正确的是( )
A. 在标准状况下,22.4L SO3含有的电子数为40 NA
B. 足量MnO2与400mL10mol/L盐酸加热时反应,转移的电子数为2NA
C. 向50ml18mol/L的H2SO4溶液中加入足量的铜片加热充分反应后.被还原的H2SO4的微粒数小于0.45NA
D. 向100ml12mol/L的HNO3溶液中加入足量的铜片充分反应后,生成的NO2的分子数等于0.6NA
难度: 中等查看答案及解析
-
将
通入适量NaOH溶液,产物中可能有NaCl、
、
,且
的比值仅与温度高低有关,当
时,下列有关说法正确的是( )
A. 改变温度,反应中转移电子的物质的量n的范围:
B. 改变温度,产物中NaCl的最小理论产量为
C. 参加反应的氣气的物质的最为
D. 某温度下,若反应后
,则溶液中
难度: 中等查看答案及解析
-
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和
、NO的混合气体4.48L,这些气体与一定体积氧气混合后通入水中,所有气体完全被水吸收生成硝酸,若向所得硝酸铜溶液中加入5mol/LNaOH溶液至
恰好完全沉淀,消耗NaOH溶液的体积是60mL.(气体体积均在标准状况下测定,下同)。下列说法不正确的是( )
A. 参加反应的硝酸是0.5mol
B. 消耗氧气的体积是1.68L
C. 混合气体中含
3.36L
D. 此反应过程中转移的电子为0.6mol
难度: 困难查看答案及解析