-
下列关于反应热和热化学反应的描述中正确的是
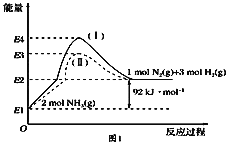
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ba(OH)2反应的中和热ΔH=2×(-57.3) kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)===2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C. 氢气的燃烧热为285.5 kJ·mol-1,则电解水的热化学方程式为2H2O(l)== 2H2(g)+O2(g)ΔH=+285.5 kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
难度: 困难查看答案及解析
-
汽车尾气中NO产生的反应为:N2(g)+O2(g)⇌2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化.下列叙述正确的是
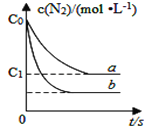
A. 温度T下,该反应的平衡常数
B. 温度T下,随着反应的进行,混合气体的密度减小
C. 曲线b对应的条件改变可能是加入了催化剂
D. 若曲线b对应的条件改变是温度,可判断该反应的△H<0
难度: 中等查看答案及解析
-
下列物质在常温下发生水解时,对应的离子方程式正确的是
①NaHCO3:HCO3-+H2O
CO32-+H3O+
②NH4Cl:NH4++H2O
NH3·H2O+H+
③CuSO4:Cu2++2H2O
Cu(OH)2+2H+
④NaF:F-+H2O===HF+OH-
A. ①② B. ②③ C. ①③ D. ②④
难度: 中等查看答案及解析
-
下图表示溶液中c(H+)和c(OH-)的关系,下列判断错误的是
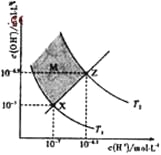
A. 两条曲线间任意点均有c(H+)×c(OH-)=Kw
B. M区域内任意点均有c(H+)<c(OH-)
C. 图中T1<T2
D. XZ线上任意点均有pH=7
难度: 困难查看答案及解析
-
下图是对10mL一定物质的量浓度的盐酸用一定物质的量浓度的NaOH溶液滴定的图像,依据图像推出盐酸和NaOH溶液的物质的量浓度是下表内各组中的
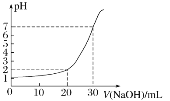
选项
溶液
A
B
C
D
C(HCl)/mol·L-1
0.12
0.04
0.03
0.09
c(NaOH)/mol·L-
0.04
0.12
0.09
0.03
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
下列有关电解质溶液的说法正确的是
A. 向0.1 mol·L-1 CH3COOH溶液中加入少量水,溶液中c(H+)/c(CH3COOH)减小
B. 将CH3COONa溶液从20 ℃升温至30 ℃,溶液中c(CH3COO-)/c(CH3COOH)∙c(OH-)增大
C. 向盐酸中加入氨水至中性,溶液中
>1
D. 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液pH<7
难度: 困难查看答案及解析
-
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为2CH2=CH2+O2===2CH3CHO.下列有关说法不正确的是
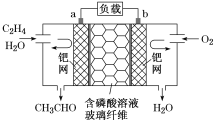
A. 每有0.1molO2反应,则迁移H+0.4mol
B. 负极反应式为CH2=CH2-2e-+H2O=CH3CHO+2H+
C. 电子移动方向:电极a→磷酸溶液→电极b
D. 该电池为不可充电电池
难度: 困难查看答案及解析