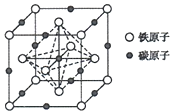
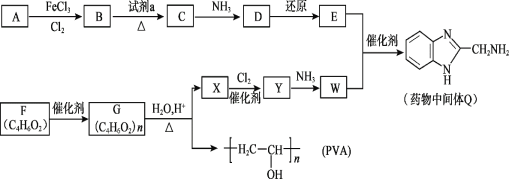
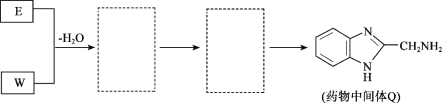
-
短周期W、X、Y、Z、Q五种元素的原子序数依次递增,W和Z位于同一主族。已知W的氢化物可与Q单质在光照条件下反应生成多种化合物,Y的氧化物是一种比较好的耐火材料,也是工业上冶炼Y的原料,X的最高价氧化物对应的水化物可与Z单质反应产生常见的还原性气体单质E。下列说法不正确的是
A. X、Z的最高价氧化物相互化合,生成的产物可用作防火剂
B. 电解X、Q元素组成的化合物的饱和溶液常被用于工业上制备X单质
C. W、X、Q三种元素都能形成多种氧化物
D. Y、Q形成的化合物是强电解质
难度: 中等查看答案及解析
-
《新修本草》中关于“青矾”的描述:“本来绿色,新出窟未见风者,正如琉璃,烧之赤色”。《物理小识》中说:“青矾厂气熏人,衣服当之易烂,栽木不茂”,下列相关叙述不正确的是
A. 赤色固体可能是Fe2O3
B. 青矾宜密闭保存,防止氧化变质
C. 青矾燃烧过程中发生了电子转移
D. “青矾厂气”可能是CO和CO2
难度: 中等查看答案及解析
-
设阿伏加德罗常数的值为NA,下列叙述正确的是
A. 等质量的N2O和CO2中,分子数均为NA
B. 3.1g 31P与3.2g 32S中,中子数均为1.6NA
C. 0.4 mol BaCl2与0.4 mol Na2O2中,阴离子数均为0.8NA
D. 1mol正丁烷与1mol异丁烷中,化学键数均为14NA
难度: 中等查看答案及解析
-
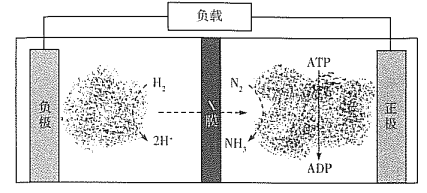
下图所示为工业合成氨的流程图。有关说法错误的是
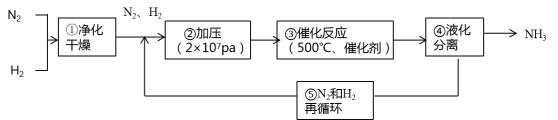
A. 步骤①中“净化”可以防止催化剂中毒
B. 步骤②中“加压”既可以提高原料的转化率,又可以加快反应速率
C. 步骤③、④、⑤均有利于提高原料的转化率
D. 产品液氨除可生产化肥外,还可用作制冷剂
难度: 简单查看答案及解析
-
山道年蒿中提取出一种具有明显抗癌活性的有机物X,其结构简式如下图所示。下列有关说法错误的是
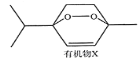
A. 该物质的分子式为C10H16O2
B. 该物质不可能所有的碳原子共平面
C. 该物质的一氯代物共有7种
D. 该物质能发生加成、取代、氧化、消去、还原等反应
难度: 中等查看答案及解析
-
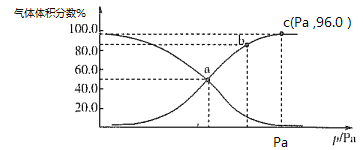
298K时,用0.1000mol/L NaOH溶液滴定20.00mL同浓度的甲酸溶液过程中溶液pH与NaOH溶液体积的关系如图所示(已知:HCOOH溶液的Ka=l.0×10-4.0)
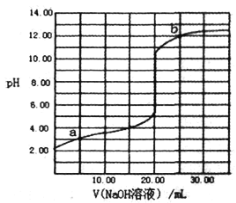
下列有关叙述正确的是
A. 该滴定过程应该选择甲基橙作为指示剂
B. 图中a、b两点氷的电离程度:b>a
C. 当加入10.00mL NaOH溶液时,溶液中:c(HCOO−)>c(H+)>c(Na+)>c(OH−)
D. 当加入20.00mL NaOH溶液时,溶液pH>8.0
难度: 中等查看答案及解析
-
《Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是
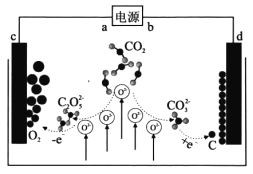
A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e−=C+3O2−
D. 转移lmol电子可捕获CO2 11.2L(标况下)
难度: 中等查看答案及解析