-
判断强弱电解质的标准是( )
A. 导电能力 B. 相对分子质量 C. 电离程度 D. 溶解度
难度: 中等查看答案及解析
-
下列物质均可用作燃料电池池的燃料,其中最环保的是
A.氢气 B.甲烷 C.乙醇 D.汽油
难度: 简单查看答案及解析
-
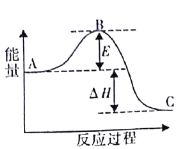
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A.增加压强 B.降低温度 C.增大CO的浓度 D.更换催化剂
难度: 中等查看答案及解析
-
将铁制自来水管与下列材料做成的水龙头连接,锈蚀最快的铁水管连接的是
A.铜水龙头 B.铁水龙头 C.塑料料水龙头 D.锌水龙头
难度: 简单查看答案及解析
-
已知CH3OH(l)的燃烧热为-726kJ·mol-1,对于反应2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(?)△H=-1452kJ·mol-1中水的状态判断正确的是
A.气态 B.液态 C.固态 D.无法判断
难度: 简单查看答案及解析
-
下列关于中和热测定的实验描述正确的是
A.需要用到的仪器是酒精灯,烧杯,温度计,量筒,环形玻璃搅拌棒
B.中和热测定可以是所有的酸和碱
C.环形玻璃搅拌棒的搅拌方式是上下搅动
D.实验所取NaOH物质的量稍大于HCl,会导致中和热的数值偏高
难度: 中等查看答案及解析
-
下列自发反应不可用熵判据来解释的是
A.CaCO3(s)+2HCl(aq)=CaCl2(aq)+CO2(g)+H20(1)
B.NH4Cl(s)=NH3(g)+HCl(g)
C.2H2(g)+O2(g)=2H2O(l)
D.2C(s)+O2(g)=2CO(g)
难度: 简单查看答案及解析
-
已知4P(红磷,s)
P4(白磷,s)△H=+17kJ·mol-l,下列推论正确的是
A.当1mol白磷转变成红磷时放出17kJ热量
B.当4g红磷转变成白磷时吸收17kJ热量
C.正反应是一个放热反应
D.白磷热稳定性比红磷大
难度: 中等查看答案及解析
-
反应4A(g)+3B(g)
2C(g)+2D(g)在四种不同情况下的反应速率分别为:
①v(A)=0.45mol/(L•s)
②v(B)=0.6mol/(L·s)
③v(C)==0.4mol/(L·s)
③v(D)=0.45mol/(L•s)
下列有关反应速率的比较中正确的是
A.④>③>②>① B.④<③=②<① C.①>②>③>④ D.④>③=②>①
难度: 简单查看答案及解析
-
在密闭容器中进行如下反应:I2(g)+H2(g)
2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol•L-1 、0.3mol•L-1、0.2mol•L-1,一定条件下当反应达到平衡时,各物质的浓度有可能是
A.H2为0.15mol•L-1 B.HI为0.35mol•L-1
C.I2为0.2mol•L-1 D.HI为0.4mol•L-1
难度: 中等查看答案及解析
-
在室温下,等体积的酸和碱的溶液混合后,pH一定小于7的是
A.pH=3的醋酸跟pH=11的Ba(OH)2 B.pH=3的盐酸跟pH=11的氨水
C.pH=3硫酸跟pH=11的NaOH D.pH=3的HNO3跟pH=11的KOH
难度: 简单查看答案及解析
-
将等体积、等物质的量浓度的NaClO与NaOH溶液混合,下列离子浓度关系正确的是
A.c(ClO-)=c(OH-) B.c(ClO-)+c(OH-)=c(Na+)
C.c(H+)>c(OH-) D.2c(ClO-)+2c(HC1O)=c(Na+)
难度: 中等查看答案及解析
-
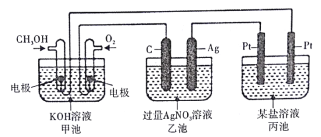
依据下列甲、乙、丙三图判断,下列叙述不正确的是

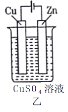

A.甲是原电池,乙是电镀装置
B.甲、乙装置中,锌极上均发生氧化反应
C.乙、丙装置中,阳极均发生氧化反应而溶解
D.丙装置中,若粗铜中含有Au、Ag、Fe、Zn等杂质,电解后Au、Ag形成阳极泥
难度: 中等查看答案及解析
-
牙齿表面由一层硬的、成分为Ca3(PO4)3OH的物质保护,它在唾液中存在下列平衡:Ca3(PO4)3OH
5Ca2++3PO43-+OH-,已知Ca3(PO4)3F的溶解度比Ca3(PO4)3OH(s)更小,为了保护牙齿,世界各地均采用了不同的措施。下列措施中不能保护牙齿的是
A.少吃甜食 B.在牙膏中加入适量氟化物添加剂
C.在饮用水中加入拧檬片 D.在牙膏中添加适量的Ca2+或PO43-离子
难度: 中等查看答案及解析
-
可逆反应aX(g)+b Y(g)
cZ(g)在一定温度下的一密闭容器内达到平衡后,t0时改变某一外界条件,化学反应速率(u)一时间(t)图象如下图。则下列说法中正确的是( )

A.若a+b=c,则t0时只能是增大了容器的压强
B.若a+b=c,则t0时只能是加入了催化剂
C.若a+b≠c,则t0时只能是增大了容器的压强
D.若a+b≠c,则t0时只能是加入了催化剂
难度: 中等查看答案及解析
-
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示。据图判断不正确的是

A.I是盐酸,II是醋酸
B.b点酸的总浓度大于a点酸的总浓度
C.溶液的导电性a>b>c
D.a、b、c三点KW的数值相同
难度: 中等查看答案及解析