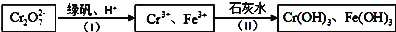-
盐在化学工业中有重要的应用,请回答下列问题。
(1)用离子方程式表示FeCl3可作净水剂的原因:______________________________。
(2)常温下,在pH=3的硫酸与pH =11的Na2S溶液中,水电离出来的c(OH-)之比为_______
(3)物质的量浓度相等的下列溶液①NH4Cl②NH4 HSO4③(NH4 ) 2SO4④CH3 COONH4⑤NH3 • H2O,溶液中的C(NH4 +)由大到小的顺序是__________________(用序号表示)。
(4)25℃,两种酸的电离平衡常数如下表:
| Ka1 | Ka2 |
| H2SO3 | 1.3x10-2 | 6.3x10-8 |
| H2CO3 | 4.2x10-7 | 5.6x10-11 |
①0.10 mol • L-1NaHSO3溶液中离子浓度由大到小的顺序为__________________
②向NaHCO3溶液中通入少量二氧化硫时反应的离子方程式为__________________________
(5)已知 25 ℃ 时 Ksp[Mg(OH)2] =1.8×10-11, Ksp[Cu(OH)2] =2.2 ×10-20.25 ℃时,向浓度均为0.1 mol • L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,先生成________(填化学式)沉淀;当体系中两种沉淀共存时, =_______。
=_______。
-
盐在化学工业中有重要的应用,请回答下列问题
(1)用离子方程式表示FeCl3可作净水剂的原因:___________________ 。
(2)常温下,在pH=3的硫酸与pH=11的Na2S溶液中,水电离出来的c(OH-)之比为_____ , 向Na2S溶液中加入AlCl3溶液时,产生白色沉淀和有臭鸡蛋味的气体,其离子方程式为:_________________。
(3)c(NH4+)相等的下列溶液① NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4
⑤NH3 H2O,溶液的物质的量浓度由小到大的顺序是__________ (用序号表示)
(4)已知t ℃时AgCl的Ksp=2×10-10 ;(2)在t ℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列正确的是 _______
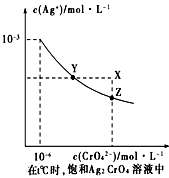
A.在t ℃时,Ag2CrO4的Ksp为1×10-9
B.t ℃时,在饱和Ag2CrO4溶液中加入K2CrO4 可使溶液由Y点到X点
C.在t ℃时,以0.01mol/L AgNO3溶液滴定20mL0.01 mol/L KCl和0.01 mol/L的K2CrO4的混合溶液,Cl-先沉淀
D.在t ℃时,AgCl的溶解度大于Ag2CrO4
(5)已知某温度时:Ksp[Fe(OH)3]=1×10-38,Ksp[Cu(OH)2]=1×10-20。在该温度下向Fe3+、Cu2+均为0.01mol•L-1的溶液中逐滴加入NaOH溶液,要Fe3+完全沉淀,而Cu2+不产生沉淀,溶液中PH应控制的范围是_______。(当离子浓度小于1×10-5mol/L时,认为完全沉淀)。
-
盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______

A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
-
盐在化学工业中有重要的应用,请回答下列问题:
(1)用化学方程式表示配制FeCl3溶液时常加入浓盐酸的原因______________________________________________
(2)常温下,在pH=3的Al2(SO4)3溶液与pH=11的Na2S溶液中,水电离出来的c(OH﹣)之比为______,将两溶液混合后,产生白色沉淀和有臭鸡蛋味的气体,其反应的离子方程式为_________________________
(3)c(NH4+)相等的下列溶液①NH4Cl ②NH4HSO4 ③(NH4)2SO4 ④CH3COONH4 ⑤NH3·H2O,溶液的物质的量浓度由小到大的顺序是______________________________________________________ (用序号表示)
(4)已知t℃时①AgCl的Ksp=2×10﹣10;②在t℃时,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示.下列正确的是_______

A.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
B.在t℃时Ag2CrO4的Ksp为1×10-12
C.在t℃时反应:Ag2CrO4(s)+2Cl-(aq) 2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数为2.5×107
D.在t℃时以0.01mol/L的AgNO3溶液滴定20mL浓度均为0.01mol/L的KCl和K2CrO4的混合溶液,CrO42-先沉淀
-
FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高 效,且腐蚀性小。请回答下列问题:
效,且腐蚀性小。请回答下列问题:
(1)FeCl3净水的原理是(用离子方程式表示) 。FeCl3溶液 腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2废液得到FeCl3。
①若酸性FeCl2废液中c(Fe2+)=2.0×10-2mol·L-1,c(Fe3+)=1.0×10-3mol·L-1,
c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
□ClO3―+□Fe2++□ =□Cl―+□Fe3++□ 。
(3 )生成聚合氧化铁的离子方程式为:xFe3++yH2O
)生成聚合氧化铁的离子方程式为:xFe3++yH2O Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
Fex(OH)y(3x-y)++yH+ 欲使平衡正向移动可采用的方法是(填序号) 。
a.降温 b.加水稀释 c.加入NH4Cl d.加入NaHCO3
-
运用相关原理,回答下列各小题:
(1)25℃时,某FeCl3溶液的pH=2,则此溶液中由水电离产生的c(OH-)=___________;用离子方程式表示FeCl3溶液用于净水的原因:______________________。
(2)已知NaHSO4在水中的电离方程式 NaHSO4 = Na++H++SO42-。在NaHSO4溶液中c(H+)______c(OH-)+c(SO42-)(填“>”、“=”或“<”下同);用硫酸氢 钠与氢氧化钡溶液制取硫酸钡,若溶液中SO42-完全沉淀,则反应后溶液的pH______7
(3)分析下表提供的数据:
| 化学式 | 电离常数 |
| HClO | Ka=3×10-8 |
| H2CO3 | Ka1=4.3×10-7 |
| Ka2=5.6×10-11 |
①84消毒液(有效成分为NaClO)久置于空气中会失效,写出发生反应的离子方程式: _____________________________________________
②判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序: ____________
-
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶解平衡均属于化学平衡.根据要求回答问题
I、铝盐的水解原理在生活中应用广泛,如明矾常作净水剂,其净水的原理是_________(用离子方程式表示);如硫酸铝常作泡沫灭火器原料之一,其原理是________________(用离子方程式表示)。
II、5℃时,将0.01mol CH3COONa和0.002mol HCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①____________________________;②____________________________;③____________________________。
(2)溶液中共有__________种不同的粒子(指分子和离子)。
(3)在这些粒子中,浓度为0.01mol·L-1的是__________,浓度为0.002mol·L-1的是____________。
(4)__________和__________两种粒子物质的量之和等于0.01mol。
(5)在0.5mol·L-1的NaHSO3溶液中滴入石蕊,溶液变红。试回答有关问题:
①该溶液中HSO 的电离程度_________(填“大于”、“小于”或“等于”)HSO
的电离程度_________(填“大于”、“小于”或“等于”)HSO 的水解程度。
的水解程度。
②溶液中Na+、HSO3-、SO32-、H+、OH-、H2SO3、H2O等粒子的浓度由大到小的顺序为__________。
III、含Cr2O72﹣的废水毒性较大,某工厂废水中含5.0×10-3mol·L﹣1的Cr2O72﹣.为了使废水的排放达标,进行如下处理:
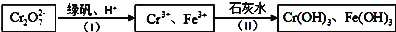
(1)绿矾为FeSO4·7H2O,反应(I)中FeSO4与Cr2O72﹣ 的物质的量之比为_________.
(2)常温下若处理后的废水中c(Cr3+)=6.0×10﹣7mol·L﹣1,则处理后的废水的pH=______.(Ksp[Cr(OH)3]=6.0×10﹣31)
-
已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1) FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2 溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3 沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O 晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg ,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL 该溶液于锥形瓶中,用c mol/L 的K2Cr2O7 酸性溶液(用稀硫酸酸化) 滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
-
已知Ksp[Fe(OH)3]=2.6×10-39,回答下列问题:
(1) FeCl3溶液可用做净水剂,其净水原理为(用离子方程式表示):______________________。
(2)某酸性MgCl2 溶液中含有少量FeCl3,为得到纯净的MgCl2溶液,可加入___________调节溶液的pH=4,使溶液中的Fe3+变为Fe(OH)3 沉淀,此时溶液中的c(Fe3+)=_________________。
(3)由FeCl3·6H2O 晶体得到纯的无水FeCl3的合理方法是:______________________________。
(4)草酸亚铁是制备高纯度活性铁粉的原料,其样品纯度测定步骤如下:准确称取草酸亚铁(FeC2O4)样品wg ,将其研成粉末后溶于适量的稀硫酸中(假设杂质不反应)配成250omL溶液。准确量取20mL 该溶液于锥形瓶中,用c mol/L 的K2Cr2O7 酸性溶液(用稀硫酸酸化) 滴定至终点,消耗滴定液VmL(还原产物为Cr3+,氧化产物为Fe3+和CO2)。
①滴定时反应的离子方程式为____________________________________。
②该草酸亚铁样品的纯度为___________________________。
-
化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l) NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L−1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }

① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.1 mol·L−1AgNO3溶液中加入2 mL 0.1 mol·L−1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
| 步骤2:向滤液b中滴加0.1 mol·L−1 KI溶液。 | 出现浑浊 |
| 步骤3:向白色沉淀c中滴加0.1 mol·L−1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
=_______。