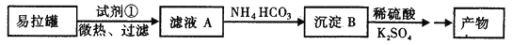-
化学平衡移动原理在生产、生活、科研中有重要应用。
(1)生活中明矾[KAl(SO4)2·12H2O]常用作净水剂,其净水的原理是_____(用离子方程式表示)。
(2)工业上在850℃时用钠还原熔融态氯化钾的方法制备金属钾,发生的反应方程式为:Na(l) + KCl(l) NaCl(l) + K(g),能制备钾的原因是_______。
NaCl(l) + K(g),能制备钾的原因是_______。
(3)测得某工厂废水中含Cr2O72–的浓度为3.0×10–4 mol·L−1,常温下,对该有害离子的处理流程如下:{已知:绿矾的化学式为FeSO4·7 H2O, Ksp [Cr(OH)3]=6.0×10–31 }

① 步骤(Ⅰ)中发生反应的离子方程式为_________。
② 若忽略加入各种试剂后的废水体积变化,则Cr3+开始沉淀的pH为_________。
(4)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。查阅资料:25℃时,Ksp (AgCl)=1.8×10–10,Ksp (AgI)=8.3×10–17。
| 操作步骤 | 现象 |
| 步骤1:向2 mL 0.1 mol·L−1AgNO3溶液中加入2 mL 0.1 mol·L−1 NaCl溶液,得到浊液a,过滤。 | 得滤液b和白色沉淀c |
| 步骤2:向滤液b中滴加0.1 mol·L−1 KI溶液。 | 出现浑浊 |
| 步骤3:向白色沉淀c中滴加0.1 mol·L−1 KI溶液。 | 白色沉淀变为黄色 |
① 浊液a中存在沉淀溶解平衡(用方程式表示)______________。
② 用化学平衡原理解释步骤3中的实验现象_________。
-
化学与生产、生活密切相关,下列叙述错误的是( )·
A.用热的的纯碱溶液清除灶具上的油污
B.用硫酸清洗锅炉中的水垢
C.用明矾[KAl(SO4)2 ·12H2O]作净水剂,除去水中悬浮的杂质
D.用Na2S作沉淀剂,除去废水中的Cu2+和Hg2+
-
生活中常用的净水剂KAl(SO4)2·12H2O(明矾)是一种复盐,在造纸等方面应用广泛。实验室中,采用废易拉罐( 主要成分为Al,含有少量的Fe、Mg杂质)制备明矾的过程如下图所示。回答下列问题:
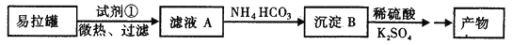
(1)为尽量少引入杂质,试剂①应选用__________ (填标号)。
A.HCl溶液 B.H2SO4 溶液 C.氨水 D.NaOH溶液
(2)沉淀B的化学式为______________;将少量明矾溶于水,溶液呈弱酸性,其原因是_________________________________ (用离子方程式表示)。
(3)科学研究证明NaAlO2 在水溶液中实际上是Na[Al(OH)4](四羟基合铝酸钠),易拉罐溶解过程中主要反应的化学方程式为_______________________________________。
(4)常温下,等pH的NaAlO2 和NaOH两份溶液中,由水电离出的c(OH-)前者为后者
的108倍,则两种溶液的pH=__________。
-
按要求回答下列问题:
(1)亚硫酸电离方程式_____________。
(2)明矾[KAl(SO4)2·12H2O]能用作净水剂,结合化学用语解释原因_____________。
(3)以KOH作电解质的氢氧燃料电池,负极的电极反应式为_____________。
-
日常生活中常用的净水剂-----明矾,明矾[KAl(SO4)2·12H2O]属于
A.酸 B.盐 C.碱 D.氧化物
-
日常生活中常用的净水剂-----明矾,明矾[KAl(SO4)2·12H2O]属于
A.酸 B.盐 C.碱 D.氧化物
-
日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质。写出水解反应的离子方程式为:________
-
日常生活中,可用明矾[KAl(SO4)2•12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体,氢氧化铝胶体可以吸附杂质.写出发生水解反应的离子方程式为________.
-
(5分)日常生活中,可用明矾[KAl(SO4)2·12H2O]作为净水剂,这是因为:明矾溶于水发生水解反应,生成氢氧化铝胶体。
(1)该反应的离子方程式为: ①。
为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念,AG=lg[c(H+)/c(OH-)]。
(2)中性溶液的AG= ② 。
(3)常温下,测得用明矾净化过的净水溶液PH=6,则溶液的 AG=③,由水电离的c(H+)=④。
-
化学知识广泛应用于生产、生活中,下列叙述不正确的是( )
A.纯碱可以用作锅炉除垢时CaSO4的转化剂
B.“地沟油”禁止食用,但可用于生产肥皂
C.明矾和ClO2均可用作净水剂,且净水原理相同
D.为防止电池中的重金属等污染土壤和水体,应积极开发废电池的综合利用技术
NaCl(l) + K(g),能制备钾的原因是_______。