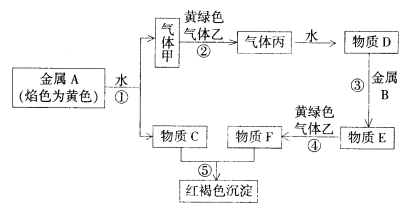
-
下列各组数值或物理量中,都不随水的“物质的量”的变化而变化的是
A. 水的沸点;水分子的数目 B. 水的质量;水的相对分子质量
C. 水的体积;水中所含原子的数目 D. 水的密度;水的摩尔质量
难度: 中等查看答案及解析
-
将过量二氧化碳分别通入:①BaCl2溶液②K2SiO3溶液③Ca(ClO)2溶液④饱和Na2CO3溶液⑤澄清石灰水,最终溶液中有白色沉淀析出的是( )
A. ②③ B. ②④ C. ②③④ D. ①④⑤
难度: 简单查看答案及解析
-
在硫酸铁溶液中,加入少量铜粉至完全溶解后,又加入一定量铁粉,充分反应后有残余固体,则下列判断正确的是
A. 最后得到的溶液中只含Cu2+
B. 残余固体可能为铁、铜混合物
C. 残余固体一定全部是铜
D. 最后得到的溶液中含有Fe3+
难度: 困难查看答案及解析
-
环境是人类生存和活动的场所。下列有关环境问题的说法不正确的是( )
A.生活垃圾应分类回收处理
B.用单质硅制成光电池,有利于环境保护
C.酸雨主要是由排放到空气中的CO2随雨水降落而形成的
D.用Cu、O2与稀H2SO4反应代替Cu与浓H2SO4反应制胆矾是绿色化学的体现
难度: 简单查看答案及解析
-
空气质量报告的各项指标可反映出空气的质量,下列气体已纳入我国空气质量报告的是( )
A.CO2 B.N2 C.SO2 D.O2
难度: 简单查看答案及解析
-
下列各项中不正确的是
选项
A
B
C
D
物品标签

药品:×××



分析
该试剂应装在橡胶塞的细口瓶中
该药品不能与皮肤直接接触
该物质受热易分解
该物质浓度为18.4 mol/L
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列离子在指定溶液中可以大量共存的是( )
A.c(H+)=1 mol·L-1溶液中:K+、Fe3+、I-、SO32-
B.某无色透明溶液中:Fe3+、NH4+、NO3-、SCN-
C.能使酚酞变红的溶液中:Na+、Cl-、SiO32-、NO3-
D.c(OH-)=1 mol·L-1溶液中:HCO3-、K+、Na+、AlO2-
难度: 简单查看答案及解析
-
下列有关反应的离子方程式正确的是( )
A.氯气溶于水:Cl2+H2O===H++Cl-+HClO
B.Fe溶于足量稀硫酸:2Fe+6H+===2Fe3++3H2↑
C.AlCl3溶液中滴入过量稀氨水:Al3++4OH-===AlO2-+2H2O
D.过氧化钠投入水中:Na2O2+2H2O===O2↑+2OH-+2Na+
难度: 简单查看答案及解析
-
合理使用仪器、恰当存放药品是化学实验安全、顺利进行的保障。下列“使用方法”与对应的“应用举例”不相符的是( )
选项
使用方法
应用举例
A
验纯后加热
H2还原Fe2O3
B
振荡分液漏斗后放气
CCl4萃取碘水中的I2
C
先撤导管后撤酒精灯
用排水集气法收集制取的氧气
D
剩余药品不能放回原瓶
截取一段后剩余的镁条
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
一定条件下,通过单质间化合反应一步可得到的是( )
A.FeCl2 B.SO3 C.Na2O D.HClO
难度: 简单查看答案及解析
-
食盐分散到酒精中形成直径在1nm~l00nm之间的超细粒子,这样的分散系是
A. 悬浊液 B. 溶液 C. 胶体 D. 乳浊液
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.生石灰、熟石灰、石灰石都属于碱 B.盐类物质一定含有金属离子
C.凡能电离出H+的化合物均属酸 D.Si02、SO2均属酸性氧化物
难度: 简单查看答案及解析
-
下列实验现象的描述错误的是( )
A.氢气在氯气中燃烧产生苍白色火焰
B.铁与水蒸气反应,生成红色的固体
C.切开的金属钠露置在空气中,切面很快会变暗
D.将打磨过的铝箔在酒精灯上加热,铝箔熔化但不滴落
难度: 简单查看答案及解析
-
下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
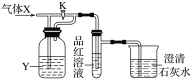
选项
A
B
C
D
X
CO
SO2
CO2
Cl2
Y
浓H2SO4
NaHCO3饱和溶液
Na2SO3溶液
NaHSO3饱和溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列各组物质,按酸、碱、盐、非电解质的顺序排列的是( )
A.硫酸、胆矾、氯化镁、二氧化碳 B.硝酸、纯碱、干冰、苏打水
C.醋酸、消石灰、明矾、铜 D.氯化氢、苛性钠、NaHCO3、氨气
难度: 简单查看答案及解析
-
下列实验现象与结论均正确的是( )
选项
实验操作
实验现象
实验结论
A
向未知液中滴加氯水,再滴加KSCN溶液
溶液呈红色
未知液中一定含有Fe2+
B
向无色溶液中滴加氯水,再加CCl4振荡,静置
溶液分层,下层呈紫红色
无色溶液中含有I-
C
红热的木炭与浓硫酸反应,产生的气体通入澄清石灰水
澄清石灰水变浑浊
反应只生成了CO2
D
向某溶液中通入HCl气体
溶液中产生气泡
溶液一定含有CO32-
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.SO2也可以用于杀菌、消毒,但食用经SO2增白后的食品是对身体有害的
B.SO2、漂白粉、活性炭、Na2O2都能使红墨水褪色,且原理相同
C.因为SO2具有漂白性,所以它能使湿润的红布条、溴水、酸性KMnO4溶液、石蕊试液褪色
D.等物质的量的SO2和Cl2混合后通入装有湿润的有色布条的集气瓶中,漂白效果更好
难度: 简单查看答案及解析
-
下列实验操作中所用仪器合理的是( )
A.用 100 mL 量筒量取 5.2 mL 盐酸 B.用 10 mL 量筒量取 5.2 mL 盐酸
C.用托盘天平称取 25.02 g NaCl D.用100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸
难度: 简单查看答案及解析
-
设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,11.2 L氧气所含的原子数为NA
B.标准状况下,1.12 L H2O所含的原子数为0.1NA
C.1.8 g NH4+离子中含有的电子数为NA
D.71g Cl2与水反应时,转移的电子数为2NA
难度: 中等查看答案及解析
-
自然界里常见金属元素存在最多的是Al,其次是铁,接着是铜。然而铜冶炼出来的时间却比铝要早的多,究其原因,最合理的解释是( )
A.铜矿较易还原,铝矿很难还原
B.铜矿较易氧化,铝矿很难氧化
C.铜矿颜色较深,易发现,铝矿颜色较浅,不易发现
D.矿石在地下埋藏,铜矿最浅,容易开发,铝矿埋得深,难开发
难度: 简单查看答案及解析
-
将足量的铜片与
浓硫酸加热充分反应,收集到标准状况下的
气体VL,下列对此反应的有关说法中错误的是
A.该反应体现了浓硫酸的酸性和强氧化性
B.反应结束后两种反应物均有剩余
C.被还原的硫酸为
D.参加反应的Cu为
难度: 中等查看答案及解析
-
用等质量的金属钠进行下列实验,其中生成氢气最多的是
A.把钠放入足量稀盐酸中 B.将钠用铝箔包好并刺些小孔,再放入水中
C.把钠放入硫酸铜溶液中 D.把钠放入足量水中
难度: 中等查看答案及解析
-
下列溶液中Cl-浓度最小的是 ( )
A.250mL 1mol/L AlCl3溶液 B.200mL 2mol/L MgCl2溶液
C.1L 2.5mol/L NaCl溶液 D.300mL 5mol/L KClO3溶液
难度: 简单查看答案及解析
-
“比较”是化学研究物质性质的基本方法之一,请运用比较法解答下列问题:已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧化物反应。如:2Na2O2+2CO2=2Na2CO3+O2, Na2O2+CO=Na2CO3。则Na2O2与SO2反应的化学方程式为( )
A.SO2+Na2O2=Na2SO4 B.2SO2+2Na2O2=2Na2SO3+O2
C.SO2+Na2O2=Na2SO3 D.SO2+Na2O2=Na2SO4 +O2
难度: 简单查看答案及解析
-
3.84 g Fe和Fe2O3的混合物溶于120 mL的盐酸,刚好完全反应。生成0.03 mol H2,向反应后的溶液中加入KSCN检验,溶液不显色。则原混合物中Fe和Fe2O3的物质的量之比为( )
A.1:2 B.1:4 C.2:1 D.4:1
难度: 简单查看答案及解析