-
下列对古文献记载内容理解错误的是
A. 《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐。
B. 《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作
C. 《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和槽入甑,蒸令气上……其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏。
D. 《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
难度: 中等查看答案及解析
-
化学与生产、生活、社会密切相关。下列说法错误的是
A.“血液透析”和“静电除尘”利用了胶体的不同性质
B.制造普通玻璃的原料为石英砂(SiO2)、石灰石(CaCO3)和纯碱
C.高锰酸钾溶液、酒精、双氧水能杀菌消毒,都利用了强氧化性
D.亚硝酸盐具有氧化性,可使血液中的低铁血红蛋白氧化成高铁血红蛋白,因而失去携氧能力而引起组织缺氧使人体中毒
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A.常温常压下,124 g P4中所含P-P键数为4NA
B.1 mol SO2与足量O2在一定条件下反应生成SO3,转移电子总数为2NA
C.Cu与浓硝酸反应生成4.6 g NO2和N2O4混合气体时,转移电子数为0.1NA
D.0.5L 0.5 mol·L-1醋酸溶液中含有的分子数小于0.25NA
难度: 中等查看答案及解析
-
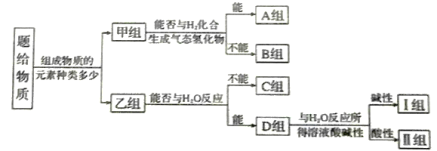
常温下,下列各组离子在指定溶液中能大量共存的是
A.c(Fe2+)=1 mol·L-1的溶液中:K+、Fe3+、ClO-、SO42-
B.由水电离的c(H+)=1×10-13 mol·L-1溶液中:Na+、K+、SO42-、Cl-
C.可使紫色石蕊试液变红的无色溶液中:Na+、CO32-、K+、ClO-
D.含有HCO3-的溶液中:K+、Al3+、NO3-、Ca2+
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A.氯化铁溶液吸收H2S:S2-+2Fe3+=Fe2++S↓
B.铜溶于稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
C.氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D.(NH4)2SO4溶液和Ba(OH)2溶液反应:NH4++SO42-+Ba2++OH-=BaSO4↓+NH3·H2O
难度: 中等查看答案及解析
-
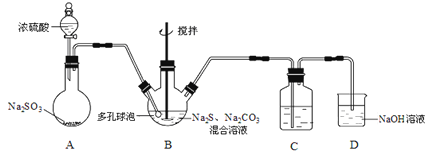
下列有关实验原理、方法和结论都正确的是
A.已知Cu2O+2H+=Cu2++Cu+H2O,H2还原CuO后所得红色固体能完全溶于稀硝酸,说明还原产物是铜
B.实验室中的CCl4含有少量溴,加适量的苯,振荡、静置、分液,可除去其中的溴
C.取一定量的水垢加入稀盐酸,生成能使澄清石灰水变浑浊的气体,说明水垢的主要成分为CaCO3、MgCO3
D.用蒸馏水、酚酞、BaCl2溶液和已知浓度盐酸标准液作试剂,可测定NaOH固体(杂质仅为Na2CO3)的纯度
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是

A.洗涤沉淀时(如图2),向漏斗中加适量蒸馏水,搅拌并滤干
B.选择合适的试剂,用图1所示装置可分别制取少量CO2、NO和O2
C.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有足量酸性KMnO4溶液、浓硫酸的洗气瓶
难度: 中等查看答案及解析
-
下列有关实验操作及现象和结论均正确的是
验操作及现象
结论
A
向某溶液中加入NaOH溶液,微热,产生能使湿润的蓝色石蕊试纸变红的气体
该溶液中含有NH4+
B
向铅丹(Pb3O4)中滴加浓盐酸,生成黄绿色的气体
氧化性:Pb3O4>Cl2
C
将SO2通入溴水中,溶液褪色
证明SO2有漂白性
D
向溶液X中滴加新制氯水,再滴加几滴KSCN溶液,溶液变红色
溶液X中含Fe2+
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
用“银-Ferrozine”法检测室内甲醛含量的原理如下:

下列说法错误的是
A.标准状况下,11.2 L CO2中含C=O键的数目为6.02×1023
B.反应①的化学方程式为2Ag2O+HCHO=4Ag+CO2↑+H2O
C.理论上吸收HCHO与消耗Fe3+的物质的量之比为4:1
D.30 g HCHO被氧化时转移电子数目为4×6.02×1023
难度: 困难查看答案及解析
-
利用自然资源制备相关化学物质,下列化学工艺不可行的是
A.提取食盐后母液
含Br2的液体
粗溴
纯溴
B.石英砂
粗硅
粗四氯化硅
高纯硅
C.FeS2
SO2
H2SO3
H2SO4
D.铝土矿
Na[Al(OH)4]溶液
Al(OH)3
Al2O3
铝
难度: 困难查看答案及解析
-
向一定量的Fe、FeO和Fe2O3的混合物中加入60mL 4 mol·L-1的稀硝酸,恰好使混合物完全溶解,放出1.344 L NO(标准状况),往所得溶液中加入KSCN溶液,无红色出现.若用足量的氢气在加热下还原相同质量的混合物,能得到铁的物质的量为
A.0.09 mol B.0.12 mol C.0.16 mol D.0.21 mol
难度: 困难查看答案及解析