-
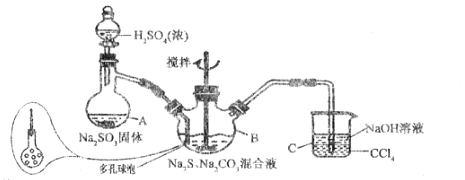
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。己知它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性,广泛地应用于照相等工业中。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
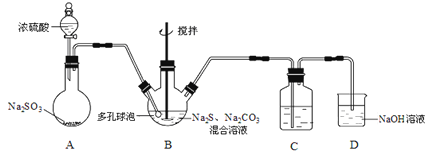
(1)装置A中发生反应的化学方程式是_____________。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为_____________________,生成的硫代硫酸钠粗品可用_______________洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是___________,表明SO2吸收效率低的实验现象是C中溶液颜色很快褪色。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是__________(写出-条)。
(4)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_______________________。
(5)粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250mL的溶液待用。另取25mL 0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________________。(己知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-)
-
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。已知它易溶于水,难溶于乙醇,加热易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
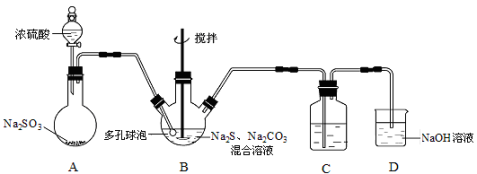
(1)装置A中发生反应的化学方程式是 。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为 ,生成的硫代硫酸钠粗品可用 洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是 ,表明SO2吸收效率低的实验现象是C中溶液 。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是 (写出一条)。
(4)本实验所用的Na2CO3中含少量NaOH,检验含有NaOH的实验方案为: (实验中供选用的试剂及仪器: CaCl2溶液、Ca(OH)2溶液、酚酞溶液、蒸馏水、pH计、烧杯、试管、滴管。提示:室温时CaCO3饱和溶液的pH=9.5)
-
(12分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”。它易溶于水,难溶于乙醇,加热易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:实验具体操作步骤为:
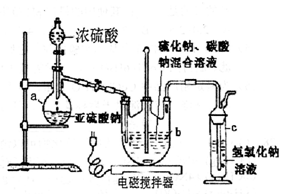
①开启分液漏斗,使硫酸慢慢滴下,适当调节螺旋夹,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电磁搅拌器搅动。
②至析出的硫不再消失,控制溶液的pH接近
7时,停止通入SO2气体。
③抽滤所得的滤液,转移至蒸发皿中,水浴加热
浓缩,直到溶液表面出现晶膜。
④冷却结晶、抽滤、洗涤。
⑤将晶体放入烘箱中,在40~45℃左右干燥
50~60min,称量。
请回答以下问题:
(l)仪器a的名称是 ;
(2)步骤②中若控制pH值小于7,则产率会下降,请用离子方程式解释原因: 。
(3)步骤③中不能将溶液蒸发至干的原因是 ;晶膜通常在溶液表面出现的原因是 。
(4)步骤④中洗涤硫代硫酸钠晶体所用试剂的结构式是 。
(5)为检验制得的产品的纯度,该实验小组称取5,0克的产品配制成250mL硫代硫酸钠溶液,并用间接碘量法标定该溶液的浓度:在锥形瓶中加入25mL 0.0lmol·L-1 KIO3溶液,并加入过量的KI并酸化,发生下列反应:5I-+IO3-+6H+=3I2+3H2O,再加入几滴淀粉溶液,立即用所配Na2S2O3溶液滴定,发生反应:I2+2S2O =2I-+S4O
=2I-+S4O ,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
,当蓝色褪去H半分钟不变色时到达滴定终点。实验数据如下表:
| 实验序号 | 1 | 2 | 3 |
| Na2S2O3溶液体积(mL) | 19.98 | 20.02 | 21.18 |
则该产品的纯度是____ ,间接碘量法滴定过程中可能造成实验结果偏低的是____ 。
A.滴定管末用Na2S2O3溶液润洗 B.滴定终点时仰视读数
C.锥形瓶用蒸馏水润洗 D.滴定管尖嘴处滴定前无气泡,滴定终点发现气泡
-
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
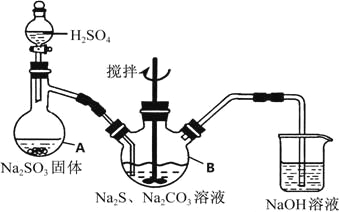
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称_____________,步骤④中洗涤时,为了减少产物的损失的试剂可以是_______
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因_____________
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论_____________
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol•L﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为_______mL,产品的纯度为_______%
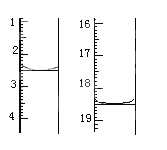
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为________。
-
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、易分解,在酸性溶液中不能稳定存在。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1) 步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式表示原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)常用Na2S2O3溶液测定废水中Ba2+ 浓度,步骤如下:取废水25.00mL,控制适当的酸度加入足量 K2Cr2O7溶液,得BaCrO4沉淀;过滤、洗涤后,用适量稀盐酸溶解,此时全部转化为Cr2O72-;再加过量KI溶液,充分反应后得混合溶液V mL,将其平均分成4等份,加入淀粉溶液作指示剂,用0.0010 mol.L-1 的Na2S2O3溶液进行滴定,反应完全时,相关数据记录如下表所示:
| 编号 | 1 | 2 | 3 | 4 |
| 消耗Na2S2O3标准溶液的体积/mL | 18.02 | 17.98 | 18.00 | 20.03 |
部分反应离子方程式为:
① Cr2O72-+6I-+14H+ 2Cr3++3I2+7H2O; ②I2+2S2O32-
2Cr3++3I2+7H2O; ②I2+2S2O32- 2I-+S4O62-。
2I-+S4O62-。
①判断达到滴定终点的现象是__ _____________
②从表格所给数据计算:一份待测溶液消耗Na2S2O3溶液的平均体积为 ml
③废水中Ba2+的物质的量浓度__________________。
(5)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为_________________。
-
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定型剂,也可用于纸浆漂白作脱氧剂,它易溶于水,难溶于乙醇,加热、遇酸均易分解,工业上常用亚硫酸钠法、硫化碱法等制备,某实验模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体均匀的通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸
②直至析出的浑浊不再消失,并控制溶液的PH接近7时,停止通入SO2气体
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O
④在经过滤、洗涤、干燥.得到所需产品
(1)写出仪器A的名称 ,步骤④中洗涤时,为了减少产物的损失的试剂可以是
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液PH<7,请用离子方程式解释原因
(3)最后得到的产品可能含有反应Na2SO4杂质,请设计实验检测产品中是否存在Na2SO4(已知BaS2O3不溶于水),简要说明实验操作.现象和结论
(4)测定产品纯度
①准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂用0.1000mol•L﹣1碘的标准溶液滴定,反应原理为2S2O32﹣+I2=S4O32﹣+2I﹣,滴定起始和终点的滴定管液面位置如图则消耗碘的标准溶液体积为 mL,产品的纯度为 %
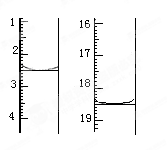
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3•5H2O的质量分数的测量结果________(填“偏高”“偏低”或“不变”)。
(5)Na2S2O3常用于脱氧剂,在溶液易被Cl2氧化SO42﹣,该反应的离子方程式为 .
-
(15分)硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、遇酸均易分解。工业上常用亚硫酸钠法、硫化碱法等制备。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如下图:

实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸。
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体。
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3·5H2O。
④再经过滤、洗涤、干燥,得到所需的产品。
(1)写出仪器A的名称 步骤④中洗涤时,为了减少产物的损失用的试剂可以是 。
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因 。
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式 。
(4)最后得到的产品中可能含有Na2SO4杂质。请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论: 。
(5)测定产品纯度
准确称取1.00 g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O +2I-。滴定起始和终点的液面位置如图:则消耗碘的标准溶液体积为_______mL。产品的纯度为 %。
+2I-。滴定起始和终点的液面位置如图:则消耗碘的标准溶液体积为_______mL。产品的纯度为 %。
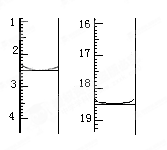
(6)Na2S2O3常用作脱氯剂,在溶液中易被Cl2氧化成SO42-,该反应的离子方程式为__________________。
-
硫代硫酸钠(Na2S2O3•5H2O)俗名“大苏打”,又称为“海波”,易溶于水,难溶于乙醇,加热,遇酸均易分解。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图所示,请回答下列问题。
实验具体操作:
Ⅰ.开启分液漏斗,使浓硫酸慢慢滴下,适当调节分液漏斗的滴速,使反应产生的SO2气体较均匀地通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,至微沸。
Ⅱ.直至出现的浑浊不再消失,并控制溶液的pH接近7时,停止通SO2气体。
(1)仪器A的名称为______;B中多孔球泡的作用是______;装置C的作用是______。
(2)为了保证硫代硫酸钠的产量,装置B中溶液pH不能小于7,请用离子方程式解释原因______。
(3)为了尽可能得到较纯的Na2S2O3溶液,三颈烧瓶B中Na2S和Na2CO3的物质的量投料比应该为______。
(4)所得产品中常含有硫酸钠杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液等
| 实验步骤 | 现象 |
| ①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
| ③ ______ | ④有乳黄色沉淀, ______ |
| ⑤静置,取上层清液 ______ | ⑥ ______ |
(5)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水配制成100 mL溶液。
②滴定:取0.00950mol•L-1的K2Cr2O7标准溶液20.00mL,硫酸酸化后加入过量KI,发生反应:Cr2O72-+6I-+14H+═3I2+2Cr3++7H2O.然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32-═S4O62-+2I-.加入淀粉溶液作为指示剂,继续滴定,当溶液______,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为______%(保留1位小数)。
-
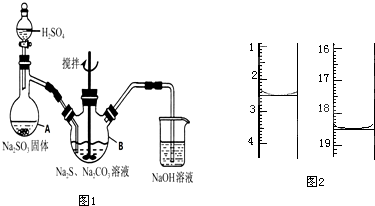
硫代硫酸钠(Na2S2O3·5H2O)俗名“大苏打”,又称为“海波”,可用于照相业作定影剂,也可用于纸浆漂白作脱氯剂等。它易溶于水,难溶于乙醇,加热、遇酸均易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图1:
实验具体操作步骤为:
①开启分液漏斗,使硫酸慢慢滴下,适当调节分液的滴速,使反应产生的SO2气体较均匀地
通入Na2S和Na2CO3的混合溶液中,同时开启电动搅拌器搅动,水浴加热,微沸.
②直至析出的浑浊不再消失,并控制溶液的pH接近7时,停止通入SO2气体.
③趁热过滤,将滤液加热浓缩,冷却析出Na2S2O3•5H2O.
④再经过滤、洗涤、干燥,得到所需的产品.
(1)写出仪器A的名称_____________,步骤④中洗涤时,为了减少产物的损失用的试剂可以是
___________;
(2)为了保证硫代硫酸钠的产量,实验中不能让溶液pH<7,请用离子方程式解释原因___________;
(3)写出三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式___________;
(4)最后得到的产品中可能含有Na2SO4杂质.请设计实验检测产品中是否存在Na2SO4,简要说明实验操作,现象和结论___________;
(5)测定产品纯度 准确称取1.00g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.1000mol•L-1碘的标准溶液滴定.反应原理为2S2O32-+I2═S4O62-+2I-.滴定起始和终点的液面位置如图2:则消耗碘的标准溶液体积为___________ mL,产品的纯度为___________。
-
硫代硫酸钠晶体(Na2S2O3·5H2O)俗名海波,是无色单斜晶体。 它易溶于水,不溶于乙醇,具有较强的还原性, 可应用于照相等工业中。回答下列问题:
(1)Na2S2O3·5H2O 属于________(填“纯净物”或“混合物”)。
(2)酸性条件下, S2O32-自身发生氧化还原反应生成 SO2。试写出 Na2S2O3 与盐酸反应的离子方程式:_________________________________________。
(3)亚硫酸钠法制备Na2S2O3·5H2O简易流程如下:
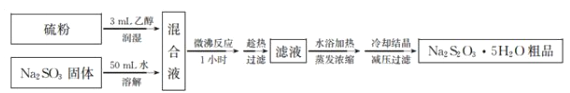
①Na2S2O3·5H2O制备原理为_________________________________________(用化学方程式表示)。
②Na2S2O3·5H2O粗品中可能含有Na2S2O3、 Na2SO4杂质,其检验步骤为:取适量产品配成稀溶液,滴加足量氯化钡溶液,有白色沉淀生成;过滤,先用蒸馏水洗涤沉淀,然后向沉淀中加入足量______________ (填试剂名称),若___________________________(填现象),则证明产品中含有Na2SO3和 Na2SO4(已知: Na2S2O3 稀溶液与BaCl2溶液无沉淀生成)。
③粗品中Na2S2O3·5H2O的质量分数的测定称取 6 g 粗品配制 250 mL 的溶液待用。另取 25.00 mL 0.0100 mol· L-1 K2Cr2O7 溶液于锥形瓶中,然后加入过量酸化的 KI 溶液并酸化和几滴淀粉溶液,立即用配制的 Na2S2O3溶液滴定至终点,消耗 Na2S2O3 溶液 25.00 mL。 滴定终点的现象是________。粗品中Na2S2O3·5H2O的质量分数为__________。已知 Cr2O72-+6I-+ 14 H+ =2Cr3++ 3I2+7H2O、 I2+2S2O32- =2I-+S4O62-。












