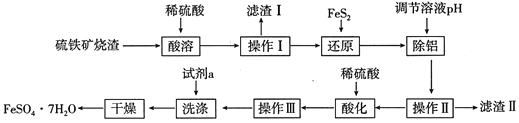
-
下列说法或表达正确的是
A.乙醇、糖类和蛋白质都是人体必需的营养物质
B.NH4I的电子式:
C.石油是混合物,其分馏产品汽油也是混合物
D.陶瓷、水晶、水泥、玻璃都属于硅酸盐
难度: 简单查看答案及解析
-
下列各项中正确的是( )
A.
中所有碳原子可能在同一平面上
B.
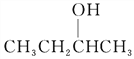 的命名为2-甲基-1-丙醇
的命名为2-甲基-1-丙醇C.乙烯、聚氯乙烯和苯分子中均含有碳碳双键
D.C4H8属于烯烃的同分异构体共有4种(含顺反异构)
难度: 中等查看答案及解析
-
化学在生产、生活和军事上有广泛的应用,下列对应关系错误的是 ( )
性质
应用
A
钠和钾的合金能导电
原子反应堆的导热剂
B
二氧化硫具有漂白性
漂白纸浆、草帽等
C
镁燃烧时发出耀眼的强光
军事上制作照明弹
D
Al(OH)3受热易分解
塑料的阻燃剂
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
X、Y、Z、W是原子序数依次增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由Z元素形成的单质,0.1mol•L-1 D溶液的pH为13(25℃)。它们满足如图转化关系,则下列说法正确的是

A.由X、Y、Z、W四种元素组成的盐溶液pH小于7
B.化合物F中含有共价键和离子键
C.0.1molB与足量C完全反应共转移电子数为0.2NA
D.Z元素的最高正价为+6
难度: 困难查看答案及解析
-
下列离子方程式正确的是 ( )
A.向NaHSO4溶液中滴加Ba(OH)2溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
B.向饱和Na2CO3溶液中通入足量CO2:2Na++CO32-+CO2+H2O=2NaHCO3↓
C.向Ca(HCO3)2溶液中加入足量Ca(OH)2溶液:Ca2++HCO3-+2OH-=CaCO3↓+CO32-+2H2O
D.向次氯酸溶液中滴加NaOH溶液:H++OH-=H2O
难度: 中等查看答案及解析
-
已知A、B、C、D为由短周期元素组成的四种物质,它们有如下所示转化关系,且D为强电解质(其他相关物质可能省略)。
下列说法不正确的是
A. 若A为非金属单质,则它与Mg反应的产物中阴、阳离子个数比可能为2:3
B. 若A为非金属单质,则其组成元素在周期表中的位置可能处于第二周期第IVA族
C. 若A是共价化合物,则A和D有可能发生氧化还原反应
D. 若A是金属或非金属单质,则常温下0. 1 mol/L的D溶液中由水电离出的c(H+)可能为10-13mol/L
难度: 困难查看答案及解析
-
在中学化学实验中研究和推广微量化实验符合绿色化学原则。下列对微量化实验装置图的解读不正确的是( )
A.
 二氧化硫性质的组合实验装置。将稀硫酸挤入干燥管胖肚中,则前端小凹槽内三种溶液均能褪色。
二氧化硫性质的组合实验装置。将稀硫酸挤入干燥管胖肚中,则前端小凹槽内三种溶液均能褪色。B.
 氨的催化合成装置。将注射器内的氮气和氢气缓缓通过加热的催化剂,即可观察到蘸有酚酞溶液的棉团变红。
氨的催化合成装置。将注射器内的氮气和氢气缓缓通过加热的催化剂,即可观察到蘸有酚酞溶液的棉团变红。C.
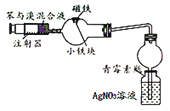 苯与液溴反应的装置。反应发生后,青霉素小瓶中产生黄色沉淀,证明该反应为取代反应。
苯与液溴反应的装置。反应发生后,青霉素小瓶中产生黄色沉淀,证明该反应为取代反应。D.
 氯气的制备与漂白装置。前端凹槽内放入高锰酸钾固体,滴入浓盐酸后,干燥的红纸不退色,湿润的红纸退色。
氯气的制备与漂白装置。前端凹槽内放入高锰酸钾固体,滴入浓盐酸后,干燥的红纸不退色,湿润的红纸退色。难度: 困难查看答案及解析
-
阿伏加德罗常数值用NA表示。下列说法中不正确的是
A.0.5 mol由F2与Ar组成的混合气体中含质子总数为9NA
B.标准状况下,足量Na2O2与5.6 L CO2反应转移电子数目为0.25NA
C.71g Cl2通入水中,HClO、ClO-、Cl-三种微粒数目之和为2NA
D.常温下,1.5 L 1.0 mol • L-1 CuSO4溶液中阳离子数目大于1.5NA
难度: 中等查看答案及解析
-
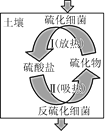
“绿水青山就是金山银山”很好地诠释了我国当前对环境保护的认识。某微生物燃料电池可很好的解决当前河流中的有机废水问题。某污染的河水中含有大量的葡萄糖,通过下面的微生物电池进行处理可达到净水的初级目标。下列有关说法错误的是( )

A.a极是负极
B.b极的电极反应式为:2NO3-+6H2O+10e-=N2+12OH-
C.右室溶液中的氢氧根可以进入左室,使左室溶液的pH增大
D.电池工作时,外电路中流过2.4mol电子时,产生标准状况下13.44LCO2
难度: 中等查看答案及解析
-
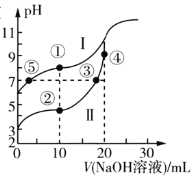
根据下列各图曲线表征的信息,得出的结论不正确的是( )
A.
 表示一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)
表示一定条件下,CH4与H2O(g)发生反应:CH4(g)+H2O(g)CO(g)+3H2(g)平衡时φ(CH4)的体积分数与Z(Z=
)和T(温度)的关系,则该反应的焓变△H>0,且b>3>a
B.
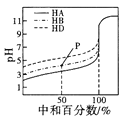 表示室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线,可以看出三种酸的电离常数关系为KHA>KHB>KHD,且滴定至P点时,溶液中:c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)
表示室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线,可以看出三种酸的电离常数关系为KHA>KHB>KHD,且滴定至P点时,溶液中:c(HB)>c(Na+)>c(B- )>c(H+)>c(OH-)C.
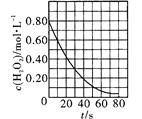 是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
是室温下H2O2催化分解放出氧气的反应中c(H2O2)随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小D.
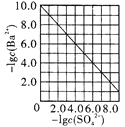 是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小
是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+)与c(SO42-)的关系曲线,说明溶液中c(SO42-)越大c(Ba2+)越小难度: 困难查看答案及解析
-
香料Z的一种合成路线如下。下列说法正确的是( )

A.①、②均是取代反应
B.X分子中所有原子处于同一平面内
C.Y和Z均能与溴水和NaOH溶液反应
D.X、Y、Z均能与酸性KMnO4溶液反应
难度: 中等查看答案及解析
-
如图为氟利昂(如CFCl 3)破坏臭氧层的反应过程示意图,下列不正确的是

A.过程Ⅰ中断裂极性键C-Cl键
B.过程Ⅱ可表示为O3 + Cl =ClO + O2
C.过程Ⅲ中O + O = O2是吸热过程
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
难度: 简单查看答案及解析