-
高锰酸钾具有强氧化性,广泛用于化工、医药、采矿、金属治炼及环境保护领域等。KMnO4的制备是以二氧化锰(MnO2)为原料,在强碱性介质中被氧化生成墨绿色的锰酸钾(K2MnO4);然后在一定pH下K2MnO4歧化生成紫色KMnO4。回答下列问题
(1)K2MnO4的制备
实验步骤
现象或解释
①称取2.5 gKClO3固体和5.2gKOH固体置于铁坩埚中,加热熔融
不用瓷坩埚的原因是____________。
②分多次加入3gMnO2固体
不一次加入的原因是__________________。
(2)KMnO4的制备
趁热向K2MnO4溶液中加入1 mol/L H3PO4溶液,直至K2MnO4全部歧化,判断全部歧化的方法是用玻璃棒蘸取溶液于滤纸上,现象为_________________________。然后趁热过滤,将滤液倒入蒸发皿中加热到液面出现晶膜,充分冷却后过滤,在80℃烘箱中干燥3h,不选用更高温度的原因是_____________________________。
(3)产品分析
i.不同pH下产品中KMnO4含量
加入H3PO4体积/mL
溶液的pH
产品质量
KMnO4质量
KMnO4质量分数
10.50
12.48
2.35
2.05
87.23
12.50
11.45
2.45
2.18
88.98
14.50
10.89
2.18
1.87
85.78
16.50
10.32
2.28
1.75
76.75
18.50
9.44
2.09
1.48
70.81
从表格中数据分析,在歧化时选择溶液的最佳pH是________________。
ii.利用H2C2O4标准溶液测定KMnO4的纯度。测定步骤如下:
①溶液配制:称取1.000g的KMnO4固体样品,放入_____________中溶解,然后冷至室温后全部转移到100mL容量瓶中,加蒸馏水至刻度线。
②滴定:移取25 mLKMnO4溶液于锥形瓶中,加少量硫酸酸化,用0.1400mol/L的H2C2O4标准溶液滴定,发生反应:2MnO4-+5H2C2O4+6H+=2Mn2++10C02+8H2O,当溶液紫色褪色且半分钟内不变色即为终点,平行滴定3次,H2C2O4溶液的平均用量为23.90mL,则样品纯度为_______________%(保留1位小数)。
高三化学实验题困难题查看答案及解析
-
碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是_____。
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。
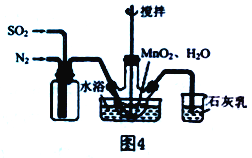
①石灰乳的作用是________。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有________。
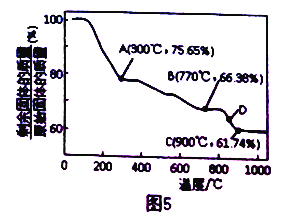
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为_______; 图中点D 对应固体的成分为______ (填化学式)。
高三化学综合题困难题查看答案及解析
-
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。
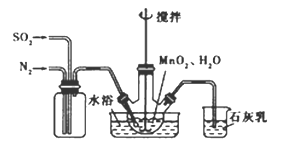
(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
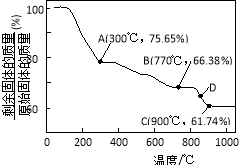
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
高三化学实验题困难题查看答案及解析
-
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.
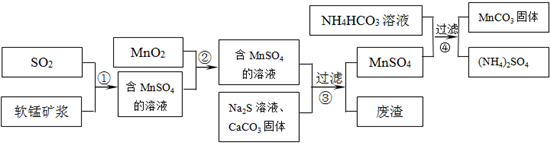
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:物质 Fe(OH)3 Fe(OH)2 Mn(OH)2 开始沉淀pH 2.7 7.6 8.3 完全沉淀pH 3.7 9.6 9.8
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.物质 MnS CuS PbS Ksp 2.5×10-13 6.3×10-36 8.0×10-28
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH______(填“大”或“小”),该流程可与______(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为______,这样设计的目的和原理是______
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是______.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是______,溶液的pH不能过低的原因是______.
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是______.(答对1个即可)高三化学解答题中等难度题查看答案及解析
-
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
第一次
第二次
第三次
第四次
体积(mL)
24.00
24.10
22.40
23.90
请回答:
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为____ 。
(3)操作②中趁热过滤的目的是 ,操作I的名称 。
(4)步骤③中用到的定量仪器有分析天平, ,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将 (填“偏大”、“偏小”或“不变”)。
高三化学实验题极难题查看答案及解析
-
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL,甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举:
第一次
第二次
第三次
第四次
体积(mL)
24.00
24.10
22.40
23.90
请回答:
(1)装置A的名称________________________________________________________________________ 。若不用温度计,本实验控制反应温度的措施为________________________________________________________________________。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为________________________________________________________________________________________________ 。
(3)操作I的名称________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________。
(4)步骤③中用到的定量仪器有________________________________________________________________________________________________________________________ ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 ________________________________________________________________________________________________________________________________________________________________________。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果________________________ ________________________________________(填“偏大”、“偏小”或“不变”)。
高三化学实验题中等难度题查看答案及解析
-
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 go。

实验流程:
①往装置A中加入2.7mL (2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL、甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举

请回答:
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为____ 。
(3)操作I的名称 。
(4)步骤③中用到的定量仪器有 ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果 (填“偏大”、“偏小”或“不变”)。
高三化学实验题困难题查看答案及解析
-
锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:
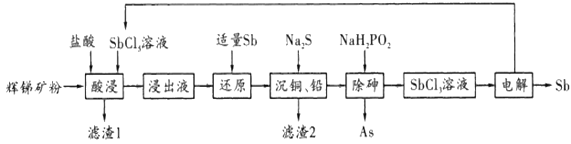
已知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS、CuO和SiO2等);
Ⅱ.浸出液主要含盐酸和SbCl3,还含SbCl2、CuCl2、AsCl3和PbCl2等杂质;
Ⅲ.常温下,Ksp(CuS)=1.0×10-36,Ksp(PbS)=9.0×10-29。
回答下列问题:
(1)NaH2PO2中P的化合价为___________。
(2)“酸浸”过程中SbCl3和Sb2S3反应有S生成,该反应的还原产物是___________(填化学式)。
(3)写出“还原”反应的化学方程式:_________________________________。
(4)已知:浸出液中C(Cu2+)=0.01mo/L、C(Pb2+)=0.1mo/L。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是______________________(填化学式);当CuS、PbS共沉时,
___________。
(5)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂还原剂的物质的量之比为_______。常温下,SbCl2溶液的pH<7,用离子方程式表示其原因:_____________________。
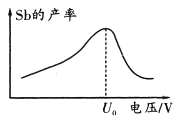
(6)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______________________;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______________________。
高三化学工业流程中等难度题查看答案及解析
-
锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:
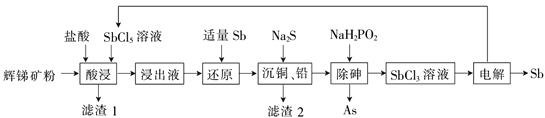
己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。
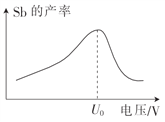
高三化学综合题困难题查看答案及解析
-
锑(Sb)广泛用于生产各种阻燃剂、陶瓷、半导体元件、医药及化工等领域。以辉锑矿为原料制备金属锑,其一种工艺流程如下:
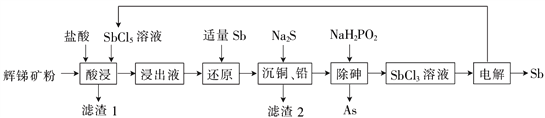
己知部分信息如下:
I.辉锑矿(主要成分为Sb2S3,还含有As2S5、PbS 、CuO和SiO2等);
II.浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AsCl3和PbCl2等杂质;
III.常温下,Ksp(CuS)=1.0×10-36 Ksp(PbS)=9.0×10-29
回答下列问题:
(1)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是________(填化学式)。
(2)写出“还原”反应的化学方程式:______________ 。
(3)已知:浸出液中:c(Cu2+)=0.01 mol·L-1、c(Pb2+)=0.10 mol·L-1。在沉淀铜、铅过程中,缓慢滴加极稀的硫化钠溶液,先产生的沉淀是_______(填化学式);当CuS、PbS共沉时,
=_________。加入硫化钠的量不宜过多,原因是_________。
(4)在“除砷”过程中,氧化产物为H3PO4。该反应中氧化剂、还原剂的物质的量之比___________。
(5)在“电解”过程中,以惰性材料为电极,阴极的电极反应式为______;“电解”中锑的产率与电压大小关系如图所示。当电压超过U0V时,锑的产率降低的原因可能是______。
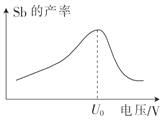
高三化学综合题困难题查看答案及解析