-
碳酸锰(MnCO3) 是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1) 工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3 ↓+ (NH4)2SO4+CO2 ↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4。加入稍过量的NH4HCO3的目的是_____。
(2) 实验室模拟工业二氧化锰制备硫酸锰装置如图4所示。
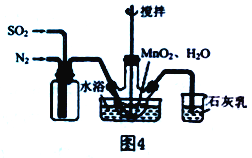
①石灰乳的作用是________。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有________。
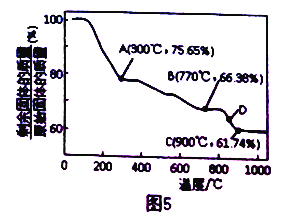
(3) MnCO3 在空气中加热易转化为不同价态的锰的氧化物,且其固体残留率随温度的变化如图5 中A、B、C、D 点所示。则300℃时,剩余固体中锰元素与氧元素的物质的量之比即n(Mn) :n(O)为_______; 图中点D 对应固体的成分为______ (填化学式)。
-
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业。
(1)工业上制备方程式为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O。反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是 。
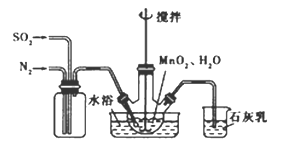
(2)实验室模拟工业二氧化锰制备硫酸锰装置如图
①石灰乳参与反应的化学方程式为 。
②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 。
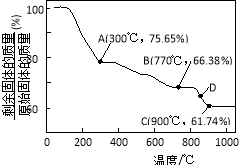
(3)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为 ;图中点D对应固体的成分为 (填化学式)。
-
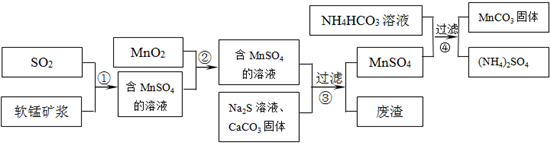
碳酸锰(MnCO3)是理想的高性能强磁性材料,也是制备Mn2O3、MnO2等锰的氧化物的重要原料,广泛用于电子、化工、医药等行业.一种制备MnCO3的生产流程如图所示.
已知生成氢氧化物的pH和有关硫化物的Ksp如下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀pH | 3.7 | 9.6 | 9.8 |
| 物质 | MnS | CuS | PbS |
| Ksp | 2.5×10-13 | 6.3×10-36 | 8.0×10-28 |
软锰矿主要成分为MnO2,其中含有铁、铝、硅的氧化物和少量重金属化合物杂质,SO2来自工业废气.流程①中主要发生的反应有:MnO2+SO2=MnSO4 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+.
(1)流程①中所得MnSO4溶液的pH比软锰矿浆的pH______(填“大”或“小”),该流程可与______(填工业生产名称)联合,生产效益更高.
(2)反应②的目的是将溶液中的Fe2+氧化成Fe3+,其离子反应方程式为______,这样设计的目的和原理是______
(3)反应③中硫化钠的作用是使重金属离子转化为硫化物沉淀,碳酸钙的作用是______.
(4)反应④发生的化学反应为:MnSO4+2NH4HCO3=MnCO3↓+(NH4)2SO4+CO2↑+H2O.
反应中通常需加入稍过量的NH4HCO3,且控制溶液的pH为6.8~7.4.加入稍过量的NH4HCO3的目的是______,溶液的pH不能过低的原因是______.
(5)软锰矿中锰的浸出有两种工艺:
工艺A:软锰矿浆与含SO2的工业废气反应 工艺B:软锰矿与煤炭粉混合,焙烧后加稀硫酸溶解.
其中工艺A的优点是______.(答对1个即可)
-
高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2 MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
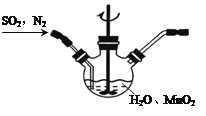
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。







③若用空气代替N2进行实验,缺点是________。(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:________。[查阅资料表明K2(H2SO4)=1.1×10-2]
-
高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇(沸点78.5 ℃),在潮湿环境下易被氧化,温度高于100 ℃开始分解。
I.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3 + MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填字母代号)。
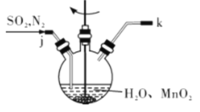
A. MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3 +2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置的接口顺序为_________(用箭头连接字母代号表示)。
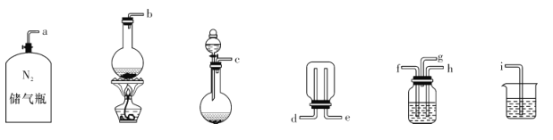
③若用空气代替N2进行实验,缺点是_______________。( 酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:
①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②...;.
③在70~80℃下烘干得到纯净干燥的MnCO3固体。
步骤②为__________,需要用到的试剂有_____________、_______、________。
II.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3):__________________(已知NiCO3为难溶于水的浅绿色固体)。
(4)证明H2SO4的第二步电离不完全:_____________。[查阅资料表明K2(H2SO4)=1.1×10-2]
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
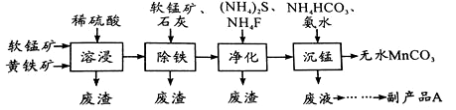
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
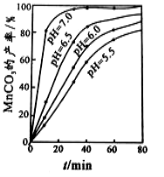
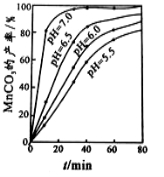
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ =2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ = Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
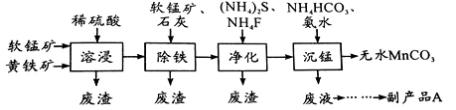
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ == Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
-
工业上以软锰矿(主要成分是MnO2,还含有少量SiO2、Fe2O3)为主要原料制备高性能的磁性材料碳酸猛(MnCO3)。其工业流程如图所示,下列说法错误的是
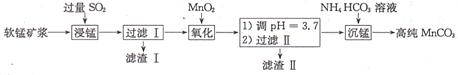
A.滤渣I可用于制造光导纤维、滤渣II可用于制作颜料
B.“浸锰”过程MnO2参与反应的化学方程式为MnO2十SO2=MnSO4
C.“沉锰”时,反应体系的温度越高,越有利于生成MnCO3
D.检验高纯碳酸锰是否洗涤干净,可选用BaCl2溶液和盐酸试剂
-
化学反应原理在化工生产和实验中有着广泛而重要的应用。
Ⅰ.利用含锰废水(主要含Mn2+、SO 、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
、H+、Fe2+、Al3+、Cu2+)可制备高性能磁性材料碳酸锰(MnCO3)。其中一种工艺流程如下:
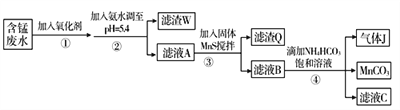
已知某些物质完全沉淀的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Mn(OH)2 | CuS | MnS | MnCO3 |
| 沉淀完全时的pH | 3.2 | 5.4 | 6.4 | 9.8 | ≥0 | ≥7 | ≥7 |
回答下列问题:
(1)过程②中,所得滤渣W的主要成分是______________________。
(2)过程③中,发生反应的离子方程式是______________________。
(3)过程④中,若生成的气体J可使澄清石灰水变浑浊,则生成MnCO3的反应的离子方程式是_______________________。
(4)由MnCO3可制得重要的催化剂MnO2:2MnCO3+O2===2MnO2+2CO2。现在空气中加热460.0 g MnCO3,得到332.0 g产品,若产品中杂质只有MnO,则该产品中MnO2的质量分数是________(用百分数表示,小数点后保留1位小数)。
Ⅱ.常温下,浓度均为0.1 mol·L-1的下列六种溶液的pH如下表:
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
(1)上述盐溶液中的阴离子,结合H+能力最强的是_______________________。
(2)根据表中数据判断,浓度均为0.01 mol·L-1的下列物质的溶液中,酸性最强的是________(填序号)。
A. HCN B. HClO C. C6H5OH D. CH3COOH E. H2CO3
Ⅲ.已知:CO(g)+H2O(g) CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
CO2(g)+H2(g) ΔH = Q kJ·mol-1其平衡常数随温度变化如下表所示:
| 温度/℃ | 400 | 500 | 850 |
| 平衡常数 | 9.94 | 9 | 1 |
请回答下列问题:
(1)上述反应的化学平衡常数表达式为___,该反应的Q____(填“>”或“<”)0。
(2)850 ℃时,向体积为10 L的反应器中通入一定量的CO和H2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则0~4 min时平均反应速率v(CO)=____。
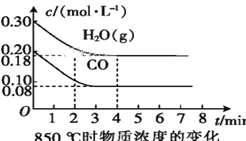
(3)若在500 ℃时进行上述反应,且CO、H2O(g)的起始浓度均为0.020 mol·L-1,该条件下,CO的最大转化率为____。
(4)若在850 ℃时进行上述反应,设起始时CO和H2O(g)共为1 mol,其中水蒸气的体积分数为x,平衡时CO的转化率为y,试推导y随x变化的关系式:____。
-
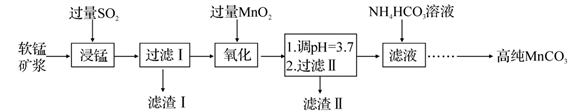
工业以软锰矿(主要成分是 MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
已知:25℃时,部分金属阳离子以氢氧化物形式沉淀时溶液的pH 如下表所示。
| 金属阳离子 | Fe3+ | Fe2+ | Mn2+ |
| 开始沉淀的pH | 2.7 | 7.6 | 8.3 |
| 完全沉淀的pH | 3.7 | 9.7 | 9.8 |
(1)“浸锰”过程中 Fe2O3与SO2反应的离子方程式为 Fe2O3+SO2+2H+ =2Fe2++SO42-+H2O,该反应是经历以下两步反应实现的。
写出ⅱ的离子方程式:_______________________。
ⅰ:Fe2O3+6H+ =2Fe3++3H2O ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_________ (填离子符号)。
(3)写出“氧化”过程中MnO2 与Fe 2+反应的离子方程式:___________。
(4)“浸锰”反应中往往有副产物 MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是;_____滤渣Ⅱ的成分是______ (写化学式);向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度不宜太高的原因是______________。
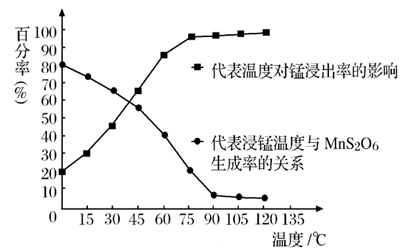
(5)加入NH4HCO3溶液后,生成 MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:__________________ 。
(6)生成的 MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是_______________。
















