-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
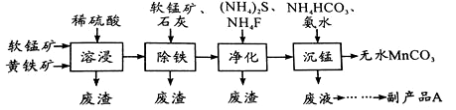
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
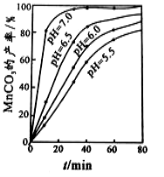
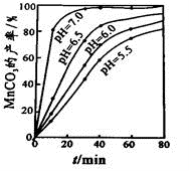
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ =2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ = Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
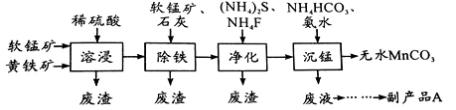
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
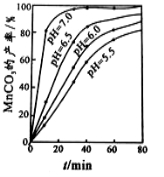
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ == Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
-
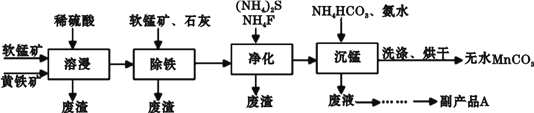
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
-
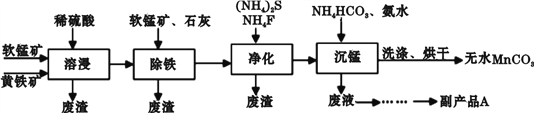
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________________。
(2)副产品A的化学式是________________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是________________;沉锰工序中判断沉淀已经洗涤干净的实验操作是________________。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:_____________ FeS2+_____________ MnO2+_____________ =_____________ Fe3++_____________ Mn2++_____________ SO42-+_____________ ,___________________
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,除了可以搅拌、将矿石研磨粉碎以外,可以采取的措施有(写两条)________。
(2)副产品A的化学式是_______。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol·L-1,则滤液中残留的c(Ca2+)=____〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,加入NH4HCO3后有无色无味的气体放出,同时有浅红色的沉淀生成,发生反应的离子方程式是_______;沉锰工序中判断沉淀已经洗涤干净的实验操作是______。
(5)已知MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解。工业上一般用少量C2H5OH洗涤的原因是________。
(6)溶浸过程中发生的主要反应如下,请完成并配平该反应的离子方程式:__FeS2+___MnO2+___=___Fe3++__Mn2++____SO42-+____,___________
-
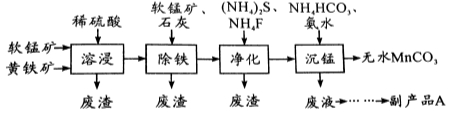
(16分)工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是:
。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。

(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是 。
(6)从沉锰工序中得到纯净MnCO3的操作方法是 。
副产品A的化学式是 。
-
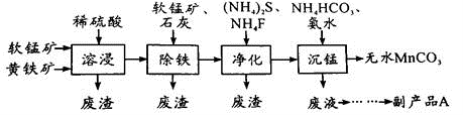
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。
(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
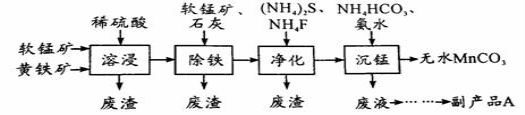
回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有(写一条) 。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是(用离子方程式表示) 。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕。
(4)沉锰工序中,298 K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。

(5)从沉锰工序中得到纯净MnCO3的操作依次是 、洗涤、 。
(6)副产品A的化学式是 。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:

回答下列问题:
(1)为了提高溶浸工序中原料的浸出率,可以采取的措施有__________________(写一条)。
(2)除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,其作用是______________。
(3)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01 mol•L-1,滤液中残留的c(Ca2+)=________________〔已知:Ksp(CaF2)=1.46×10-10〕,
(4)沉锰工序中,298K、c(Mn2+)为1.05 mol•L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是______________。

(5)沉锰工序中有CO2生成,则生成MnCO3的离子方程式是______________________。
(6)从沉锰工序中得到纯净MnCO3的操作方法是___________________。副产品A的化学式是________。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工艺流程如下:( )
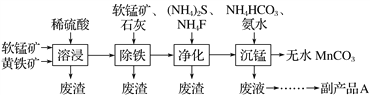
已知:净化工序的目的是除去溶液中的Ca2+、Cu2+等杂质(CaF2难溶)。
下列说法不正确的是
A. 研磨矿石、适当升高温度均可提高溶浸工序中原料的浸出率
B. 除铁工序中,在加入石灰调节溶液的pH前,加入适量的软锰矿,发生的反应为MnO2+2Fe2++4H+===2Fe3++Mn2++2H2O
C. 副产品A的化学式(NH4)2S
D. 从沉锰工序中得到纯净MnCO3的操作方法是过滤、洗涤、干燥















