-
高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇(沸点78.5 ℃),在潮湿环境下易被氧化,温度高于100 ℃开始分解。
I.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图所示,缓缓通入经N2稀释的SO2气体,发生反应H2SO3 + MnO2=MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填字母代号)。
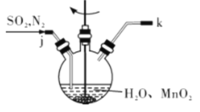
A. MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3 +2H2SO4(浓)=2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置的接口顺序为_________(用箭头连接字母代号表示)。
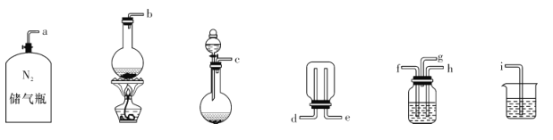
③若用空气代替N2进行实验,缺点是_______________。( 酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:
①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;
②...;.
③在70~80℃下烘干得到纯净干燥的MnCO3固体。
步骤②为__________,需要用到的试剂有_____________、_______、________。
II.设计实验方案
(3)利用沉淀转化的方法证明Ksp(MnCO3)<Ksp(NiCO3):__________________(已知NiCO3为难溶于水的浅绿色固体)。
(4)证明H2SO4的第二步电离不完全:_____________。[查阅资料表明K2(H2SO4)=1.1×10-2]
-
高纯MnCO3是广泛用于电子行业的强磁性材料。MnCO3为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于100℃开始分解。
Ⅰ.实验室以MnO2为原料制备MnCO3
(1)制备MnSO4溶液:
①主要反应装置如图,缓缓通入经N2稀释的SO2气体,发生反应H2SO3+MnO2 MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
MnSO4+H2O。下列措施中,目的是加快化学反应速率的是________(填标号)。
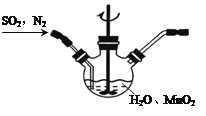
A.MnO2加入前先研磨 B.搅拌 C.提高混合气中N2比例
②已知实验室制取SO2的原理是Na2SO3+2H2SO4(浓) 2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。
2NaHSO4+SO2↑+H2O。选择下图所示部分装置与上图装置相连制备MnSO4溶液,应选择的装置有________(填标号)。







③若用空气代替N2进行实验,缺点是________。(酸性环境下Mn2+不易被氧化)
(2)制备MnCO3固体:
实验步骤:①向MnSO4溶液中边搅拌边加入饱和NH4HCO3溶液生成MnCO3沉淀,反应结束后过滤;② ……;③在70-80℃下烘干得到纯净干燥的MnCO3固体。
步骤②需要用到的试剂有________。
Ⅱ.设计实验方案
(3)利用沉淀转化的方法证明KSP(MnCO3) < KSP(NiCO3):________。
(已知NiCO3为难溶于水的浅绿色固体)
(4)证明H2SO4的第二步电离不完全:________。[查阅资料表明K2(H2SO4)=1.1×10-2]
-
高纯 是广泛用于电子行业的强磁性材料.
是广泛用于电子行业的强磁性材料. 为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于
为白色粉末,不溶于水和乙醇,在潮湿环境下易被氧化,温度高于 开始分解。
开始分解。
Ⅰ 实验室以
实验室以 为原料制备
为原料制备
 制备
制备 溶液:
溶液:
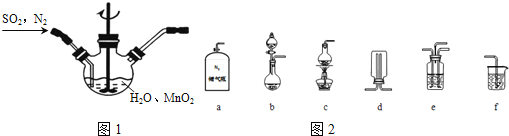
 主要反应装置如图1,缓缓通入经
主要反应装置如图1,缓缓通入经 稀释的
稀释的 气体,发生反应
气体,发生反应 ,下列措施中,目的是加快化学反应速率的是______
,下列措施中,目的是加快化学反应速率的是______ 填标号
填标号 。
。
A. 加入前先研磨
加入前先研磨  搅拌
搅拌  提高混合气中
提高混合气中 比例
比例
 已知实验室制取
已知实验室制取 的原理是
的原理是 浓
浓

 选择如图2所示部分装置与图装1置相连制备
选择如图2所示部分装置与图装1置相连制备 溶液,应选择的装置有______
溶液,应选择的装置有______ 填标号
填标号 .
.
 若用空气代替
若用空气代替 进行实验,缺点是______
进行实验,缺点是______ 酸性环境下
酸性环境下 不易被氧化
不易被氧化
 制备
制备 固体:
固体:
实验步骤: 向
向 溶液中边搅拌边加入饱和
溶液中边搅拌边加入饱和 溶液生成
溶液生成 沉淀,反应结束后过滤;
沉淀,反应结束后过滤; ;
; 在
在 下烘干得到纯净干燥的
下烘干得到纯净干燥的 固体。
固体。
步骤 需要用到的试剂有______。
需要用到的试剂有______。
Ⅱ 设计实验方案
设计实验方案
 利用沉淀转化的方法证明
利用沉淀转化的方法证明 :______
:______ 已知
已知 为难溶于水的浅绿色固体
为难溶于水的浅绿色固体
 证明
证明 的第二步电离不完全:______
的第二步电离不完全:______ 查阅资料表明
查阅资料表明
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
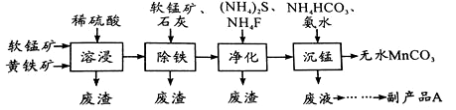
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
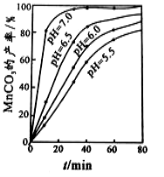
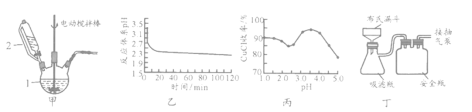
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ =2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ = Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
-
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:
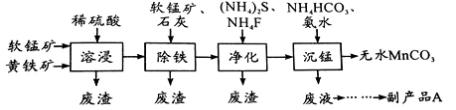
已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
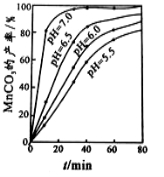
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ == 2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ == Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
-
 用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用
用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用 混合溶液与
混合溶液与 溶液反应制取
溶液反应制取 ,相关装置如图。回答以下问题:
,相关装置如图。回答以下问题:
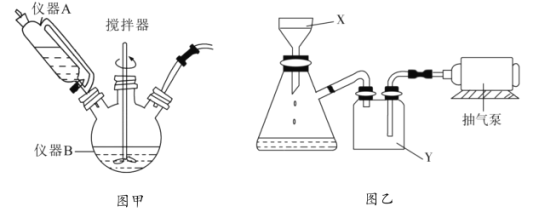
(1)图甲中仪器B的名称是__________,制备过程中 过量会发生副反应生成
过量会发生副反应生成 ,为提高产率,仪器A中所加试剂应为__________________;
,为提高产率,仪器A中所加试剂应为__________________;
(2)丙图是体系pH随时间变化关系图,制取 反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用
反应的离子方程式为____________,丁图是产率随pH变化关系图,实验过程中往往用 混合溶液代替单一
混合溶液代替单一 溶液,其中
溶液,其中 的作用是____________;
的作用是____________;
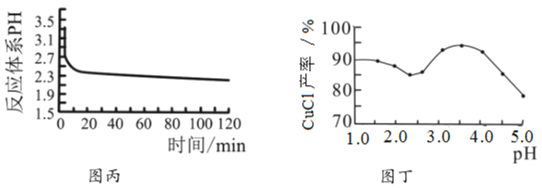
(3)反应完成后经抽滤、洗涤、干燥获得产品。抽滤装置如图乙所示,抽滤所用的仪器包括布氏漏斗、吸滤瓶、安全瓶和抽气泵。其中抽气泵的作用是使吸滤瓶与安全瓶中的____________________,跟常规过滤相比,采用抽滤的优点是____________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________。
(4) 不稳定易分解为
不稳定易分解为 ,
, 时
时 的
的 ,
, 的
的 ,把
,把 固体和
固体和 溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
溶液混合,加热,得到红色沉淀,该沉淀的化学式为___________。
-
CuCl用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。
Ⅰ.实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。相关装置及数据如下图。
回答以下问题:
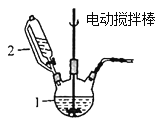
(1)甲图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_________(填“A”或“B”)。
A、CuSO4-NaCl混合液 B、Na2SO3溶液
(2)乙图是体系pH随时间变化关系图,写出制备CuCl的离子方程式_______________;丙图是产率随pH变化关系图,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是___________________________并维持pH在____________左右以保证较高产率。
(3)反应完成后经抽滤、洗涤、干燥获得产品。
抽滤所采用装置如丁图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是________________________(写一条);
洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是____________________________。
Ⅱ.工业上常用CuCl作O2、CO的吸收剂,某同学利用如下图所示装置模拟工业上测定高炉煤气中CO、CO2、N2和O2的含量。
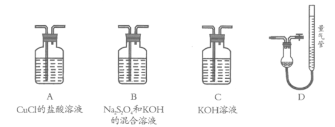
已知:Na2S2O4和KOH的混合溶液也能吸收氧气。
(4)装置的连接顺序应为_______→D
(5)用D装置测N2含量,读数时应注意______________________。
-
CuCl用于石油工业脱硫与脱色,是一种不溶于水和乙醇的白色粉末,在潮湿空气中可被迅速氧化。实验室用CuSO4-NaCl混合液与Na2SO3溶液反应制取CuCl。
回答以下问题:
(1)图中仪器1的名称是________;制备过程中Na2SO3过量会发生副反应生成[Cu(SO3)2]3-,为提高产率,仪器2中所加试剂应为_________(填“A”或“B”)。
A.CuSO4-NaCl混合液 B.Na2SO3溶液
(2)如图是体系pH随时间变化关系图:
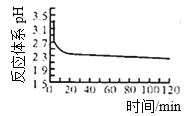
写出制备CuCl的离子方程式_______________;
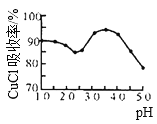
(3)如图是产率随pH变化关系图,实验过程中往往用CuSO4- Na2CO3混合溶液代替Na2SO3溶液,其中Na2CO3的作用是__________________并维持pH在____________左右以保证较高产率。
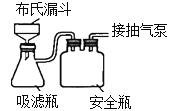
(4)反应完成后经抽滤、洗涤、干燥获得产品。抽滤所采用装置如图所示,其中抽气泵的作用是使吸滤瓶与安全瓶中的压强减小,跟常规过滤相比,采用抽滤的优点是_________________(写一条);洗涤时,用“去氧水”作洗涤剂洗涤产品,作用是__________________________。
-
(14分)铜是一种常见的金属元素,其有多种用途广泛的化合物。
I、氯化亚铜(CuCl)是一种白色粉末,不溶于乙醇,微溶于水,易溶于浓盐酸,露置在空气中迅速被氧化成碱式盐。可用于一氧化碳、乙炔等气体含量的测定。以粗铜(含Cu、Fe)为原料可制备纯净的CuCl,其流程如下:
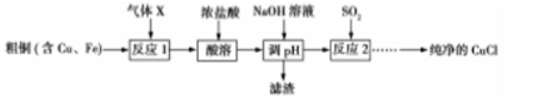
(1)气体X的化学式 ,“酸溶”采用浓盐酸的原因是 。
(2)“酸溶”所得溶液成分分析:c(CuCl2)=5mol·L-1,c(FeCl3)=1 mol·L-1。已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cu(OH)2]=4.8×10-20,当溶液中金属离子的浓度小于10-5 mol·L-1时可认为其沉淀完全,则上述流程中滴加NaOH溶液调节pH,其范围约为 (数值取整数)。
(3)反应2的离子方程式为 。
(4)设计实验提纯析出的CuCl粗晶体: 。
II、纳米氧化亚铜(Cu2O)可用作光电材料,可用电解法制得(如图)。酸性介质中Cu2O不能稳定存在,潮湿的空气中可缓慢被氧化成CuO。
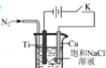
(5)阳极的电极反应式为: 。
(6)电解过程中从烧杯底部通入N2,其可能的作用:
①搅动溶液,使OH-迅速扩散;② 。
-
纯净的过氧化钙(CaO2)是白色的结晶粉末,难溶于水,不溶于乙醇、乙醚,常温下较为稳定,是一种新型水产养殖增氧剂,常用于鲜活水产品的运输.
已知:①在潮湿空气中CaO2能够发生反应:CaO2+2H2O→Ca(OH)2+H2O2 2CaO2+2CO2→2CaCO3+O2
②CaO2与稀酸反应生成盐和H2O2:CaO2+2H+→Ca2++H2O2
在实验室可用钙盐制取CaO2•8H2O,再经脱水制得CaO2.CaO2•8H2O在0℃时稳定,在室温时经过几天就分解,加热至130℃时逐渐变为无水CaO2.
其制备过程如下:
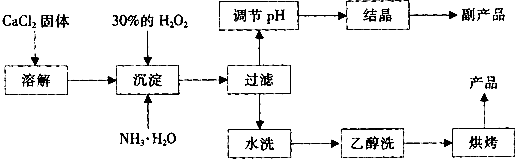
根据以上信息,回答下列问题:
(1)用上述方法制取CaO2•8H2O的化学方程式是______;
(2)为了控制沉淀温度为0℃左右,在实验室宜采取的方法是______;
(3)该制法的副产品为______(填化学式),为了提高副产品的产率,结晶前要将溶液的pH调整到合适范围,可加入的试剂是______. A.盐酸 B.氨水
(4)为了检验“水洗”是否合格,可取少量洗涤液于试管中,再滴加______.
(5)测定产品中CaO2的含量的实验步骤是:
第一步,准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2mol/L的H2SO4溶液,充分反应.
第二步,向上述锥形瓶中加入几滴淀粉溶液.
第三步,逐滴加入浓度为c mol/L的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL.(已知:I2+2S2O32-→2I-+S4O62-(无色))
①第三步中说明反应恰好完全的现象是______;②CaO2的质量分数为______ (用字母表示).


















