-
下列电离方程式书写正确的是( )
A.NaHCO3 = Na++H++CO32-
B.(NH4)2SO4
2NH4++SO42-
C.H2S
2H++S2-
D.Al(OH)3
H++AlO2-+H2O
难度: 简单查看答案及解析
-
下列说法正确的是
A.化学反应除了生成新的物质外,还伴随着能量的变化
B.据能量守恒定律,反应物的总能量一定等于生成物的总能量
C.放热的化学反应不需要加热就能发生
D.吸热反应不加热就不会发生
难度: 中等查看答案及解析
-
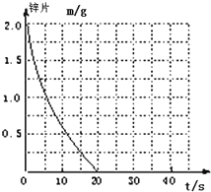
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。

A.①④ B.①②③ C.③④ D.②③
难度: 简单查看答案及解析
-
已知 H2(g) + Cl2 (g)===2HCl(g) Δ H =- 184.6 kJ · mol-1则反应:HCl(g)===1/2H2(g)+1/2Cl2(g)的ΔH 为( )
A.+184.6 kJ·mol-1 B.-92.3 kJ·mol-1
C.-369.2 kJ·mol-1 D.+92.3 kJ·mol-1
难度: 简单查看答案及解析
-
对于反应A(g)+3B(g)=4C(g)+2D(g),在相同时间内,用不同物质表示的平均反应速率如下,则反应速率最快的是 ( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
下列说法正确的是( )
A. 可逆反应的特征是正反应速率和逆反应速率相等
B. 在其他条件不变时,使用催化剂只能改变反应速率,而不能改变化学平衡状态
C. 在其他条件不变时,升高温度可以使平衡向放热反应方向移动
D. 在其他条件不变时,增大压强一定会破坏气体反应的平衡状态
难度: 中等查看答案及解析
-
已知化学反应A2(g)+B2(g)===2AB(g) ΔH= Q kJ·mol-1,
其能量变化如图所示,则Q的值正确的是 ( )
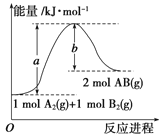
A.a-b B.a
C.-b D.b-a
难度: 简单查看答案及解析
-
下列图像分别表示有关反应的反应过程与能量变化的关系。
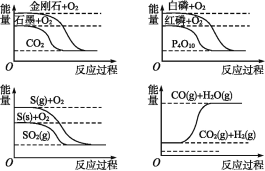
据此判断下列说法中正确的是( )
A.石墨转变为金刚石是吸热反应
B.S(g)+O2(g)
SO2(g) ΔH1,S(s)+O2(g)
SO2(g) ΔH2,则ΔH1>ΔH2
C.白磷比红磷稳定
D.CO(g)+H2O(g)
CO2(g)+H2(g) ΔH>0
难度: 简单查看答案及解析
-
对于反应C(s)+H2O(g)
CO(g)+H2(g) ;ΔH >0,下列有关说法正确的是
A.平衡常数表达式为
B.增大体系压强,平衡常数K不发生变化
C.升高体系温度,平衡常数K减小 D.增加C(s)的量,平衡正向移动
难度: 中等查看答案及解析
-
如图曲线 a 表示放热反应X(g)+Y(g)
Z(g) + M(g) + N(s)进行过程中 X 的转化率随时间变化的关系。若要改变起始条件,使反应过程按 b 曲线进行,可采取的措施是( )
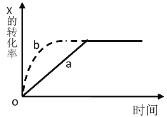
A.升高温度 B.加大 X 的投入量
C.加催化剂 D.增大体积
难度: 简单查看答案及解析
-
CO2 与 H2 合成(CH3)2O(二甲醚)是煤化工中的重要反应,有关信息如下:2CO2(g)+6H2(g)
(CH3)2O(g)+3H2O(g) ΔH<0 恒容下,该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( ) (K 表示该反应的平衡常数)
A.
 B.
B.
C.
 D.
D.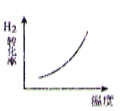
难度: 中等查看答案及解析
-
在密闭容器中发生如下反应: aX(g) + bY(g) ⇌cZ(g) +d W(g)。反应达平衡后保持温度不变,将气体体积压缩到原来的1/2,当再次达平衡时,W的浓度为原平衡时的1.8倍。下列叙述中不正确的是 ( )
A. 平衡向逆反应方向移动 B. a + b < c + d
C. Z的体积分数增加 D. X的转化率下降
难度: 简单查看答案及解析
-
在醋酸的下列性质中,可以证明它是弱电解质的是 ( )
A.1mol/L的醋酸溶液中H+浓度约为10-3mol/L B.醋酸能与水以任意比互溶
C.10mL 1mol/L的醋酸恰好与10mL 1mol/L NaOH溶液完全反应 D.醋酸的导电性比强酸溶液弱
难度: 简单查看答案及解析
-
25℃时将水不断滴入0.1mol/L的氨水中,下列变化的图象合理的是
A.
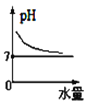 B.
B.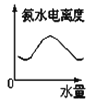 C.
C.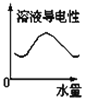 D.
D.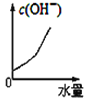
难度: 简单查看答案及解析
-
已知下列反应的平衡常数:①H2(g)+S(s)
H2S(g),K1;②S(s)+O2(g)
SO2(g),K2;则反应H2(g)+SO2(g)
O2(g)+H2S(g)的平衡常数是
A. K1+K2 B. K1-K2 C. K1×K2 D. K1/K2
难度: 简单查看答案及解析