-
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/LCuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K。
酸液都取足量、相同体积,请你帮助完成下面实验设计表(表中不留空格):
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20mol/L | 
| a.实验①和②是探究_____对锌与盐酸反应速率的影响; b.实验①和③是探究_____对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同 浓度的盐酸、醋酸与锌反应速率的区别 |
| ② | 308 | 0.20mol/L | 
|
| ③ | 298 | 0.40mol/L | 
|
| ④ | ______ | 
| 0.20mol/L |
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如下图:
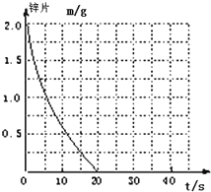
假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.____________________________
(3)某实验小组在做(1)中实验④时误加少量0.10mol/LCuCl2溶液,发现反应速率与(1)中实验①接近,加少量0.10mol/LCuCl2溶液后速率变快的原因是_________________。
-
同学们为了探究镁条与盐酸、醋酸反应时,浓度或温度对反应速率(观察镁条消失的时间)的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、4条镁条(形状、大小、质量相同)、几支试管和胶头滴管,酸液温度控制为298K和308K.
(1)该实验缺少的仪器是______.
(2)酸液都取足量、相同体积,请你帮助完成以下面实验设计表:
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20 | | a.实验①和②是探究______对镁与盐酸反应速率的影响;
b.实验①和③是探究______对镁与盐酸反应速率的影响;
c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与镁反应速率的区别. |
| ② | 308 | 0.20 | |
| ③ | 298 | 0.40 | |
| ④ | ______ | | ______ |
(3)相同温度时,镁条与相同浓度的盐酸、醋酸反应,刚开始时两者产生气体的速率盐酸______醋酸(选填“=、>或<”),镁条最先消失的是______(选填“盐酸或醋酸”,下同);如果镁条足量,选pH相同、等体积的盐酸和醋酸与镁条反应,产生气体最多的是______.
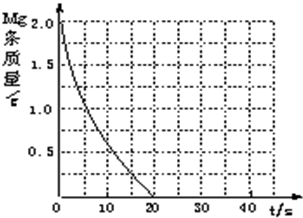
(4)若(2)中实验①镁条消失的时间是20s,则镁条剩余质量与时间关系图如右图.假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的镁条质量与时间关系曲线.
(5)某温度下,醋酸的电离平衡常数K(CH3COOH)=1.0×10-5.若醋酸的起始浓度为0.l0mol/L,则平衡时溶液的pH值是多少?(写出计算过程)
-
学校化学兴趣小组利用下列所给试剂,探究不同温度下相同质量的铝与稀盐酸反应速率的影响因素。
(实验试剂)铝条、铝粉、1mol·L—1盐酸、2mol·L—1盐酸
(设计并实验)每次实验盐酸用量均为10mL
| 实验编号 | 金属 | 温度(℃) | 盐酸的浓度 | 均收集50mL所用的时间(s) |
| ① | 铝条 | 25 | 1mol·L—1盐酸 | 32.6 |
| ② | 铝条 | 25 | c(HCl) | 18.1 |
| ③ | 铝粉 | 25 | 1mol·L—1盐酸 | 24.3 |
| ④ | 铝粉 | 100 | 1mol·L—1盐酸 | 8.3 |
(1)铝与稀盐酸反应的离子方程式为________________________。
(2)实验③和④是探究________________对该反应速率的影响。
(3)实验①和②是探究浓度对该反应速率的影响,表中c(HCl)应选取_______mol·L—1。
(4)由表中数据得出结论:_______________________________,反应速率越快。
-
碘在科研与生活中有重要作用,某兴趣小组用0.20 mol/L KI、0.4%淀粉溶液、0.20 mol/L K2S2O8、0.010 mol/L Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I-=2SO42-+I2(慢);I2+2S2O32-=2I-+S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的Na2S2O3耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物 质的量需满足的关系为:n(S2O82-):n(S2O32-) 。
质的量需满足的关系为:n(S2O82-):n(S2O32-) 。
(2)如果实验中不使用Na2S2O3溶液,可能存在的不足是 。
(3)为探究反应物浓度对化学反 应速率的影响,设计的实验方案如下表:
应速率的影响,设计的实验方案如下表:
| 实验 序号 | 试剂体积 V / mL | 显色时间 t /s |
| K2S2O8溶液 | KI溶液 | 水 | Na2S2O3溶液 | 淀粉溶液 |
| ① | 10 | 10 | 0 | 4 | 1 | 26.8 |
| ② | 5 | 10 | 5 | 4 | 1 | 54.0 |
| ③ | 2.5 | 10 | V1 | 4 | 1 | 108.2 |
| ④ | 10 | 5 | 5 | 4 | 1 | 53.8 |
| ⑤ | 5 | 7.5 | 7.5 | 4 | V2 | t1 |
| | | | | | |
表中V1 = mL,理由是 ;V2 = mL,理由是 。显色时间t1大约是 。
(4)根据表中数据可以得出的结论是 。
-
(10分)某同学想利用镁与盐酸或醋酸在不同温度下反应,探究外界条件对反应速率的影响。部分实验用表如下:
| 实验 编号 | 温度/K | 盐酸浓度 /mol·L-1 | 醋酸浓度/mol·L-1 | 实验目的 |
| ① | 298 | 0.20 | | a.实验①和②,探究温度对反应速率的影响; b.实验①和③,探究浓度对反应速率的影响; c.实验④⑤,探究温度对镁与盐酸反应和镁与醋酸反应速率的影响,哪个更大一些。 |
| ② | 308 | 0.20 | |
| ③ | 298 | 0.40 | |
| ④ | | 0.20 | 0.20 |
| ⑤ | | | |
(1)请完成上工作表(填写实验④⑤的空格)。
(2)上表实验①中,镁条消失的时间为20s。实验过程中,镁条剩余质量与时间关系如图:
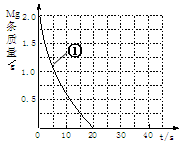
Ⅰ假设反应过程中盐酸体积不变,则要计算该反应的速率v(HCl),尚缺少的数据是________________________。
Ⅱ若反应温度每升高10℃,反应速率增大到原来的2倍;温度相同时,醋酸是相同浓度盐酸平均速度的1/2,请在图中大致画出“实验②”、“实验④中醋酸实验”的镁条质量与时间关系曲线,并用②或④注明曲线代表的实验(假设实验中所用镁完全相同,且镁均能完全溶解)。
-
某实验小组选用CaCO3固体与盐酸的反应来探究化学反应速率的影响因素,下列条件下产生气体速率最快的是
| 选项 | 酸的浓度 | 固体状态 | 温度 |
| A | 1mol/L HCl | 块状CaCO3 | 20℃ |
| B | 1mol/L HCl | 粉状CaCO3 | 25℃ |
| C | 2 mol/L HCl | 块状CaCO3 | 20℃ |
| D | 2 mol/L HCl | 粉状CaCO3 | 25℃ |
A. A B. B C. C D. D
-
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═S4O62-+2I- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的______(填化学式)耗尽后,溶液颜色将由无色变成为蓝色.为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<______.
(2)某同学设计实验如下表所示:
| 0.20mol•L-1K2S2O8溶液的体积/mL | 0.10mol•L-1Na2S2O3溶液的体积/mL | H2O的体积/mL | 0.50mol•L-1KI溶液的体积 | 淀粉溶液 |
| 实验1 | 10.0 | 4.0 | 0.0 | 4.0 | 2.0 |
| 实验2 | 9.0 | 4.0 | 1.0 | 4.0 | 2.0 |
| 实验3 | 8.0 | 4.0 | V1 | 4.0 | 2.0 |
该实验的目的是______;表中V1=______mL,理由是______.
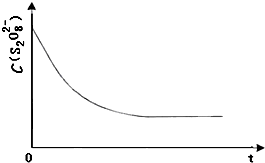
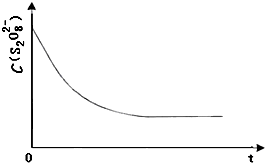
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)
-
碘在科研与生活中有重要应用.某兴趣小组用0.50mol•L-1KI、0.2%淀粉溶液、0.20mol•L-1K2S2O8、0.10mol•L-1Na2S2O3等试剂,探究反应条件对化学反应速率的影响.
已知:S2O82-+2I-═2SO42-+I2(慢) I2+2S2O32-═S4O62-+2I- (快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的______(填化学式)耗尽后,溶液颜色将由无色变成为蓝色.为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-):n(S2O82-)<______.
(2)某同学设计实验如下表所示:
| 0.20mol•L-1K2S2O8溶液的体积/mL | 0.10mol•L-1Na2S2O3溶液的体积/mL | H2O的体积/mL | 0.50mol•L-1KI溶液的体积 | 淀粉溶液 |
| 实验1 | 10.0 | 4.0 | 0.0 | 4.0 | 2.0 |
| 实验2 | 9.0 | 4.0 | 1.0 | 4.0 | 2.0 |
| 实验3 | 8.0 | 4.0 | V1 | 4.0 | 2.0 |
该实验的目的是______;表中V1=______mL,理由是______.
(3)已知某条件下,浓度c(S2O82-)~反应时间t的变化曲线如图,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)~t的变化曲线示意图(进行相应的标注)
-
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
(1)甲同学研究的实验报告如下表:
| ①分别取等体积的2 mol/L 硫酸于试管中; ②分别投入大小、形状相同 的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
该同学的实验目的是研究 ________ 对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持________条件相同。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用右图装置进行定量实验。
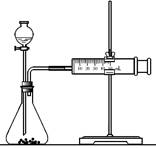
完成该实验应选用的实验药品是________
________;应该测定的实验数据是________。
-
影响化学反应速率的因素很多,某课外兴趣小组用实验的方法进行探究。
实验一:他们利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。
甲同学研究的实验报告如下表:
| 实 验 步 骤 | 现 象 | 结 论 |
| ①分别取等体积的2 mol/L硫酸于试管中;
②分别投入大小、形状相同的Cu、Fe、Mg。 | 反应快慢:
Mg>Fe>Cu | 反应物的性质越活泼,
反应速率越快。 |
(1)该同学的实验目的是_________________________________________;
要得出正确的实验结论,还需控制的实验条件是_____________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品可以是(从题中所给药品中挑选)_________________________________________________________;
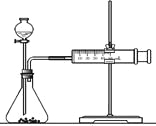
实验二:
已知: 2KMnO4+5H2C2O4+3H2SO4= K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(1)针对上述实验现象,某同学认为KMnO4与H2C2O4反应是放热反应,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你的猜想还可能是_______________的影响。
(2)若用实验证明你的猜想,除酸性高锰酸钾溶液、草酸溶液试剂外,还需要选择的试剂最合理的是__________________。
A.硫酸钾 B.硫酸锰 C.氯化锰 D.水






