-
下列化学反应中:Ag++Fe2+
Ag(固)+Fe3+(正反应放热)为使平衡体系析出更多的银,可采取的措施是
A.常温下加压 B.增加Fe3+的浓度
C.增加Fe2+的浓度 D.移去一些析出的银
难度: 简单查看答案及解析
-
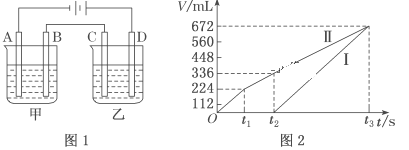
已知A、B、C、D四种物质都是气体,现在5L的密闭容器中进行反应:4A+5B
4C+6D,30s后C的物质的量增加了0.30mol。则下列有关叙述正确的是( )
A.反应开始至30s,v(A)=0.010mol·L-1·s-1
B.30s时容器中D的物质的量至少为0.45mol
C.30s时容器中A、B、C、D的物质的量之比一定是4∶5∶4∶6
D.反应开始至30s,容器中A的物质的量增加了0.30mol
难度: 中等查看答案及解析
-
根据如图所示示意图,下列说法不正确的是

A. 反应的热化学方程式可表示为C(s)+H2O(g)
CO(g)+H2(g) ΔH=(b-a) kJ·mol-1
B. 该反应过程反应物断键吸收的能量大于生成物成键放出的能量
C. a mol C和a mol H2O反应生成a mol CO和a mol H2吸收的热量一定为131.3a kJ
D. 1 mol C(g)、2 mol H、1 mol O转变成1 mol CO(g)和1 mol H2(g)放出的热量为a kJ
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列表示物质变化的化学用语中正确的是( )
A. 汽车用的铅蓄电池充电时阳极反应:PbSO4+2H2O-2e-=PbSO4+4H++SO42-
B. 利用Na2CO3溶液可除油污:CO32-+2H2O
H2CO3+2OH-
C. BaSO4的水溶液导电性极弱: BaSO4
Ba2++SO42-
D. 用醋酸除去暖瓶中的水垢:2H++ CaCO3=Ca2++CO2↑+H2O
难度: 中等查看答案及解析
-
如图所示,a、b是两根石墨棒。下列叙述正确的是( )

A.a是正极,发生还原反应
B.b是阳极,发生氧化反应
C.往滤纸上滴加酚酞试液,a极附近颜色变红
D.稀硫酸中硫酸根离子的物质的量不变
难度: 中等查看答案及解析
-
一定温度下,下列溶液的离子浓度关系式正确的是( )
A.pH=5的H2S溶液中,c(H+)=c(HS-)=1×10-5mol•L-1
B.pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1
C.pH相同的①CH3COONa②NaHCO3③NaClO三种溶液的c(Na+):①>②>③
D.pH=2的H2C2O4溶液与pH=12的NaOH溶液任意比例混合: c(Na+)+c(H+)=c(OH-)+c(HC2O4-)
难度: 困难查看答案及解析
-
25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c(H+)=10-13mol/L的溶液中:Na+、K+、SiO32-、AlO2-
B.pH=7的溶液中:Na+、Fe3+、Cl-、NO3-
C.常温下的溶液中:Cl-、Al3+、Na+、AlO2-
D.c(H+)=1×10-12mol/L的溶液中:K+、ClO-、NO3-、SO42-
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.Na2CO3溶液蒸干并灼烧可得无水Na2CO3
B.pH相同的HA和HB溶液,分别与一定浓度的氢氧化钠溶液完全中和,HA消耗的氢氧化钠溶液体积多,则可证明酸性HA<HB
C.任何温度下均能自发进行2H2O2(l)=2H2O(l) +O2(g),则该反应的△H<0,△S>0
D.除去MgCl2溶液中混有的少量FeCl3,可向溶液中加入足量MgCO3,过滤
难度: 中等查看答案及解析
-
T℃时,反应物和生成物均为气体的某反应,反应过程中浓度变化如图(Ⅰ)所示。若保持其他条件不变,温度分别为T1和T2时,B的体积分数与时间的关系如图(Ⅱ)所示,则下列结论正确的是( )

A.在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动
B.在(t1+10)min时,保持压强不变,通入稀有气体,平衡逆反应方向移动
C.T℃时,在相同容器中,若由0.1mol·L-1A、0.3mol·L-1B和0.4mol·L-1C反应,达到平衡后,C的浓度仍为0.4mol·L-1
D.在其他条件不变时,升高温度,正、逆反应速率均增大,且A的转化率增大
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向含酚酞的Na2CO3溶液中,加入少量的BaCl2固体,溶液的红色变浅
Na2CO3溶液中存在
水解平衡
B
将铜片与锌片用导线连接后,插入稀硫酸中,铜片上有气泡产生
铜将硫酸还原产生氢气
C
向浓度均为0.1 mol•L-1KCl和KI混合溶液中滴加2滴0.1 mol•L-1AgNO3溶液,振荡,沉淀呈黄色
Ksp(AgI)>Ksp(AgCl)
D
室温下,用pH试纸测得:CH3COONa溶液的pH约为9,NaNO2溶液的pH约为8
HNO2电离H+的能力比CH3COOH的强
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
已知:pKa=-lgKa,25℃时,H2A的pKal=1.85,pKa2=7.19。常温下,用0.1 mol·L-1NaOH溶液滴定20 mL 0.1 mol·L-1H2A溶液的滴定曲线如图所示。下列说法正确的是
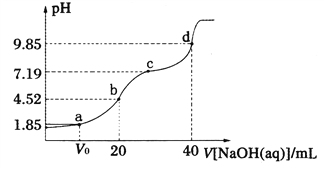
A. a点所得溶液中:V0=10 mL
B. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
C. c点所得溶液中:c(A2-)=c(HA-)
D. d点所得溶液中A2-水解平衡常数Khl=10-7.19
难度: 困难查看答案及解析
-
常温下,下列说法不正确的是( )
A.0.1mol/L的FeCl3溶液与0.01mol/L的FeCl3溶液中,Fe3+的浓度之比大于10
B.将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3·H2O的电离常数为
C.pH加和为12的强酸与弱酸混合,pH可能为6
D.0.1mol·L-1 NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S)
难度: 中等查看答案及解析
-
常温下,向一定体积0.01mol/L的Ba(OH)2溶液中逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11。若反应后溶液的体积等于Ba(OH)2溶液和NaHSO4溶液体积之和,则Ba(OH)2溶液和NaHSO4溶液体积之比是
A. 1:1 - B. 1:2 C. 1:4 D. 1:9
难度: 简单查看答案及解析
-
今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
难度: 困难查看答案及解析
-
已知Ksp(AgCl) =1.78×10-10,Ksp(Ag2CrO4)=2.00×10-12 。在只含有KCl、K2CrO4的混合溶液中滴加0.001000 mol/L的AgNO3溶液,当AgCl与Ag2CrO4共存时,测得溶液中CrO42-的浓度是5.000×l0-3mo l/L,此时溶液中Cl-的物质的量浓度是
A.8. 90×10-6mol/L B.1. 36×10-5mol/L
C.1×10-5mol/L D.4. 45×10-2mol/L
难度: 中等查看答案及解析
-
如图是一种利用锂电池“固定CO2”的电化学装置,在催化剂的作用下,该电化学装置放电时可将CO2转化为C和Li2CO3,充电时选用合适催化剂,仅使Li2CO3发生氧化反应释放出CO2和O2。下列说法中正确的是
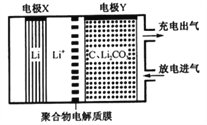
A.该电池放电时,Li+向电极X方向移动
B.该电池充电时,电极Y与外接直流电源的负极相连
C.该电池放电时,每转移4 mol电子,理论上生成1mol C
D.该电池充电时,阳极反应式为:C+2Li2CO3-4e-=3CO2↑+4Li
难度: 困难查看答案及解析
-
下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.物质的量浓度相等的①NH4HSO4溶液、②NH4HCO3溶液、③NH4Cl溶液中,pH的大小关系:②>①>③
B.常温下,将CH3COONa溶液和稀盐酸混合至溶液pH=7时c(Na+)>c(CH3COO-)>c(Cl-)=c(CH3COOH)>c(H+)=c(OH-)
C.将lmolNaClO和2molNaHCO3配制成1L混合溶液:c(HClO)+c(ClO-)=2c(HClO3-)+2c(H2CO3)+2c(CO32-)
D.浓度均为0.1mol/L的NH3·H2O和NH4Cl溶液等体积混合后,若溶液呈碱性,则溶液中:c(NH3·H2O)>c(Cl-)>c(NH4+)>c(OH-)>c(H+)
难度: 中等查看答案及解析
-
用下图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
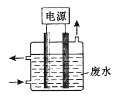
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
难度: 困难查看答案及解析
-
25℃时在10mL0.1mol·L-1Na2CO3溶液中逐滴加入0.1mol·L-1HCl溶液20mL,溶液中部分含碳微粒的物质的量随溶液pH的变化如图所示。下列说法不正确的是( )
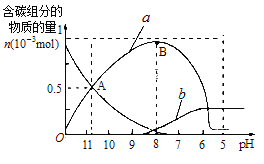
A.A点时:c(Na+)>c(CO32-)=c(HCO3-)>c(OH-)>c(H+)
B.当溶液的pH=8时,溶液中NaHCO3的物质的量浓度为0.1moL·L-1
C.a、b曲线分别代表的是HCO3-、H2CO3量的变化情况
D.Na2CO3溶液中c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
难度: 中等查看答案及解析
-
科学家设计出质子膜H2S燃料电池,实现了利用H2S废气资源回收能量并得到单质硫。质子膜H2S燃料电池的结构示意图如下图所示。下列说法不正确的是

A.电极a为电池的负极
B.电极b上发生的电极反应为:O2 +4H+ + 4e﹣=== 2H2O
C.电路中每流过4 mol电子,在正极消耗44.8LH2S
D.每17 g H2S参与反应,有1 mol H+经质子膜进入正极区
难度: 中等查看答案及解析