-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料.
(1)在25℃、101kPa时,16gCH4完全燃烧生成液态水时放出的热量是890.31kJ,则CH4燃烧的热化学方程式为_____________,
(2)已知:C(s)+O2(g)═CO2(g);△H=﹣437.3 kJ•mol﹣1
H2(g)+O2(g)═H2O(g);△H=﹣285.8 kJ•mol﹣1
CO(g)+O2(g)═CO2(g);△H=﹣283.0 kJ•mol﹣1
则煤气化反应C(s)+H2O(g)═CO(g)+H2(g) 的焓变△H=__________kJ•mol﹣1;
(3)如图所示组成闭合回路,其中,甲装置中CH4为负极,O2和CO2的混合气体为正极,稀土金属材料为电极,以熔融碳酸盐为电解质;乙装置中a、b为石墨,b极上有红色物质析出,CuSO4溶液的体积为200mL.
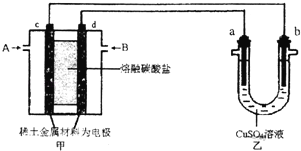
①装置中气体A为___________(填“CH4”或“O2和CO2”),d极上的电极反应式为___________;
②乙装置中a极上的电极反应式为_________.若在a极产生112mL(标准状况)气体,则甲装置中消耗CH4______mL(标准状况),乙装置中所得溶液的pH=_________.(忽略电解前后溶液体秋变化)
③如果乙中电极不变,将溶液换成饱和Na2SO3溶液,当阴极上有a mol气体生成时,同时有w g Na2SO4•10H2O晶体析出,若温度不变,剩余溶液中溶质的质量分数应为______________(用含w、a的表达式表示,不必化简)。
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则表示CH4燃烧热的热化学方程式是_______________________。
(2)已知:C(s) + O2(g) CO2(g) ΔH1 =-437.3 kJ•mol-1
CO2(g) ΔH1 =-437.3 kJ•mol-1
2H2(g) + O2(g)  2H2O(g) ΔH2 =-571.6 kJ•mol-1
2H2O(g) ΔH2 =-571.6 kJ•mol-1
2CO(g) +O2(g) 2CO2(g) ΔH3 =-566.0 kJ•mol-1
2CO2(g) ΔH3 =-566.0 kJ•mol-1
则煤气化主要反应的热化学方程式是:C(s)+ H2O(g) CO(g) + H2(g) ΔH =________kJ•mol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
CO(g) + H2(g) ΔH =________kJ•mol-1。如果该反应ΔS =+133.7 J·mol-1·K-1 ,该反应在常温下 _______自发进行(填 “能”或“不能”)。
(3) 已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则反应N2(g)+3H2(g)  2NH3 (g) ΔH =_________
2NH3 (g) ΔH =_________
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)在25 ℃、101 kPa时,16 g CH4完全燃烧生成液态水时放出的热量是890.31 kJ,则CH4燃烧的热化学方程式是_____。
(2)已知:C(s)+ O2(g) CO2(g) ΔH=-437.3 kJ•mol-1
CO2(g) ΔH=-437.3 kJ•mol-1
H2(g)+ O2(g)
O2(g) H2O(g) ΔH=-285.8 kJ•mol-1
H2O(g) ΔH=-285.8 kJ•mol-1
CO(g)+ O2(g)
O2(g) CO2(g) ΔH=-283.0 kJ•mol-1
CO2(g) ΔH=-283.0 kJ•mol-1
则煤的气化主要反应的热化学方程式是
C(s)+ H2O(g) CO(g)+ H2(g) ΔH=_____kJ•mol-1。
CO(g)+ H2(g) ΔH=_____kJ•mol-1。
-
沼气(主要成分是甲烷)是一种廉价的能源,把农村中大量存在的农作物秸秆、杂草、人畜粪便等在沼气池中发酵,便可产生沼气,沼气完全燃烧可以用来点灯、做饭。
(1)在101kPa时,32gCH4燃烧生成CO2和气态H2O,放出1604kJ的热量,写出甲烷燃烧的热化学方程式为__________________________________________________________。
(2)120℃,取CH4和过量O2的混合气体共0.4mol,点燃使其充分反应,将燃烧后的气体通过足量的碱石灰(NaOH和CaO的固体混合物)充分吸收,碱石灰增重8g。计算:原混合气体中CH4和O2的体积比是多少?
-
能源是国民经济发展的重要基础,我国目前使用的能源主要是化石燃料。
(1)熔融盐燃料电池具有高的发电效率,因而受到重视。可用熔融的碳酸盐作为电解质,向负极充入燃料气CH4,用空气与CO2的混合气作为正极的助燃气,以石墨为电极材料,制得燃料电池。工作过程中,CO32-移向__(填“正”或“负”)极,已知CH4发生反应的电极反应式为CH4+4CO32--8e-=5CO2+2H2O,则另一极的电极反应式为___。
(2)利用上述燃料电池,按如图1所示装置进行电解,A、B、C、D均为铂电极,回答下列问题。
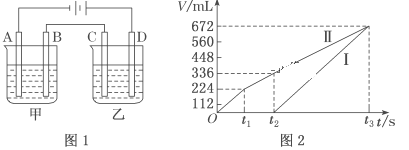
Ⅰ.甲槽电解的是200mL一定浓度的NaCl与CuSO4的混合溶液,理论上两极所得气体的体积随时间变化的关系如图2所示(气体体积已换算成标准状况下的体积,电解前后溶液的体积变化忽略不计)。
①原混合溶液中NaCl的物质的量浓度为___,CuSO4的物质的量浓度为__。
②t2时所得溶液的pH=__。
Ⅱ.乙槽为200mLCuSO4溶液,乙槽内电解的总离子方程式:___;
①当C极析出0.64g物质时,乙槽溶液中生成的H2SO4为__mol。电解后,若使乙槽内的溶液完全复原,可向乙槽中加入__(填字母)。
A.Cu(OH)2 B.CuO
C.CuCO3 D.Cu2(OH)2CO3
②若通电一段时间后,向所得的乙槽溶液中加入0.2mol的Cu(OH)2才能恰好恢复到电解前的浓度,则电解过程中转移的电子数为__。
-
17.到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为(1)CH3OH(g)+1.5O2(g)==== CO2(g)+2 ____ΔH=-704 kJ·mol-1。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能 (E)有关。
已知:H2 (g) + Cl2 (g) = 2HCl (g) △H=-185kJ/mol
E(H—H) = 436kJ/mol E(Cl—Cl) = 243kJ/mol
则E(H—Cl) = kJ/mol
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s) +  O2(g) === Cu2O(s) ΔH=-169kJ·mol-1,
O2(g) === Cu2O(s) ΔH=-169kJ·mol-1,
C(s)+  O2(g) === CO(g) ΔH=-110.5kJ·mol-1,
O2(g) === CO(g) ΔH=-110.5kJ·mol-1,
2Cu(s)+ O2(g)=== 2CuO(s) ΔH=-314kJ·mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为_________
-
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为CH3OH(g)+1.5O2(g)==== CO2(g)+2 ____ΔH=-704 kJ·mol1。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2 (g) + Cl2 (g) = 2HCl (g) △H=-185kJ/mol
E(H—H) = 436kJ/mol E(Cl—Cl) = 243kJ/mol
则E(H—Cl)= kJ/mol
(3)纳米级Cu2O由于具有优良的催化性能而受到关注。已知:
2Cu(s) +  O2(g) === Cu2O(s) ΔH=-169kJ·mol1,
O2(g) === Cu2O(s) ΔH=-169kJ·mol1,
C(s)+  O2(g) === CO(g) ΔH=-110.5kJ·mol1,
O2(g) === CO(g) ΔH=-110.5kJ·mol1,
2Cu(s)+ O2(g)=== 2CuO(s) ΔH=-314kJ·mol1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为_________
-
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式___。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol, E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=___。
(3)①如图是N2和H2反应生成2molNH3过程中能量变化示意图,请计算每生成1molNH3放出热量为:___;
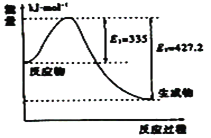
②若起始时向容器内放入1molN2和3molH2,达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为___;
(4)已知:Fe2O3(s)+3C(石墨)=2Fe(s)+3CO(g) ΔH=akJ·mol-1;
CO(g)+ O2(g)=CO2(g) ΔH=bkJ·mol-1;
O2(g)=CO2(g) ΔH=bkJ·mol-1;
C(石墨)+O2(g)=CO2(g) ΔH=ckJ·mol-1
则反应:4Fe(s)+3O2(g)=2Fe2O3(s)的焓变ΔH=___kJ·mol-1。
-
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源。
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为______。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关。已知:H2(g)+Cl2(g)=2HCl(g) △H=﹣185kJ/mol,E(H﹣Cl)=432kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣H)=_____。
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:2Cu(s)+  O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,C(s)+
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,C(s)+  O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1,则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____。
(4)如图是N2(g)和H2(g)反应生成2molNH3(g)过程中能量变化示意图:
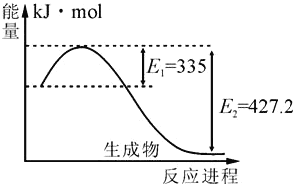
①请计算每生成1molNH3放出热量为:______。
②若起始时向容器内充入1molN2和3molH2达平衡后N2的转化率为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________。
-
到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_____________________。
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2(g)+Cl2(g)=2HCl(g)△H=﹣185kJ/mol,
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol则E(H﹣Cl)=_____________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注.已知:
2Cu(s)+ O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
O2(g)═Cu2O(s)△H=﹣169kJ•mol﹣1,
C(s)+ O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
O2(g)═CO(g)△H=﹣110.5kJ•mol﹣1,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJ•mol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式_____________。
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图:

①请计算每生成1molNH3放出热量为:_________.
②若起始时向容器内放入1molN2和3molH2达平衡后N2的为20%,则反应放出的热量为Q1kJ,则Q1的数值为_________.




