-
下列说法不正确的是( )
A.NaClO可作为漂白剂 B.NaHCO3是制做糕点馒头的膨松剂成分之一
C.液态NH3用作致冷剂 D.明矾(KAl(SO4)2·12H2O)作为消毒杀菌剂
难度: 简单查看答案及解析
-
下列叙述中不正确的是( )
A.含氮量超标的废水直接排放会造成水体富营养化
B.NO、NO2为主的氮氧化物排放是形成光化学烟雾和酸雨的一个重要原因
C.化石燃料燃烧,大气中CO2含量猛增会导致温室效应
D.减少煤、石油等化石燃料的使用不符合“绿色发展”理念
难度: 简单查看答案及解析
-
人体血红蛋白中含有Fe2+,如果误食亚硝酸盐,会使人中毒,因为亚硝酸盐会使Fe2+转变为Fe3+,生成高铁血红蛋白而丧失与O2结合的能力,服用维生素C可缓解亚硝酸盐的中毒。下列说法正确的( )
A.亚硝酸盐表现出还原性 B.维生素C可被亚硝酸盐氧化
C.维生素C表现出氧化性 D.中毒时亚硝酸盐被Fe2+氧化成硝酸盐
难度: 简单查看答案及解析
-
室温下,在强酸性和强碱性溶液中均能够大量共存的离子组是( )
A.NH4+、Cu2+、Cl-、NO3- B.K+、Na+、HCO3-、SO42-
C.Fe2+、NO3-、Na+、ClO- D.Cl-、NO3-、Na+、SO42-
难度: 简单查看答案及解析
-
下列各组中的两种物质作用,反应条件(温度、反应物浓度、用量或滴加顺序等)改变,不会引起产物改变的是( )
A.Na和O2 B.Fe与HCl C.Cu和HNO3 D.Na2CO3和HCl
难度: 简单查看答案及解析
-
下列离子方程式正确的是( )
A.钠与水反应:Na+H2O = Na++OH-+H2↑
B.氯气溶于水:Cl2+H2O=2H++Cl-+ClO-
C.氢氧化钡溶液与稀H2SO4反应:Ba2++SO42-=BaSO4↓
D.过量CO2通入氢氧化钠溶液中:OH-+CO2===HCO3-
难度: 简单查看答案及解析
-
选择合适的如下试剂组合,其中能证明Fe3+具有氧化性的是( )
供选试剂:①KSCN溶液 ②FeCl2溶液 ③氯水 ④NaOH溶液 ⑤Fe粉
A.①⑤ B.①③ C.③④ D.②③
难度: 简单查看答案及解析
-
类比是研究物质性质的常用方法之一。下列说法正确的是( )
A.CuO是碱性氧化物可以和酸反应生成盐和水,推测Fe2O3也可以和酸反应生成盐和水
B.Cu与Cl2能化合生成CuCl2,推测Fe与Cl2也能化合生成FeCl2
C.碳酸氢钠可以治疗胃酸过多,推测碳酸钠也可以治疗胃酸过多
D.Fe可以置换出CuSO4溶液中的铜,推测Na也可以置换出CuSO4溶液中的铜
难度: 简单查看答案及解析
-
下列除去物质中少量杂质的方法不正确的是( )
A.除去CO2中混有的少量HCl:用饱和碳酸钠溶液,洗气
B.除去NO中混有少量的NO2:将气体通入水中,洗气
C.除去FeCl2溶液中混有的少量FeCl3:加入过量铁粉,过滤
D.除去NaCl固体中混有的少量NH4Cl:加热
难度: 简单查看答案及解析
-
下列有关溶液中离子的检验方法合理的是( )
A.向溶液滴加盐酸,产生能使澄清石灰水变浑浊的气体,一定含有CO32-
B.向溶液滴加盐酸酸化的BaCl2溶液,产生白色沉淀,一定含有SO42-
C.向溶液滴加NaOH溶液,生成白色絮状沉淀,迅速变灰绿色,最后变红褐色,一定含有Fe2+
D.向溶液滴加Na2CO3溶液产生白色沉淀,再加盐酸白色沉淀消失,一定含有Ca2+
难度: 简单查看答案及解析
-
已知:2KMnO4 + 16HCl(浓) ═ 2KCl + 2MnCl2 + 5Cl2↑+ 8H2O,下列有关说法正确的是( )
A.KMnO4发生氧化反应 B.盐酸既表现酸性又表现还原性
C.如果有16molHCl被氧化,则生成5molCl2 D.每生成2.24 L Cl2有0.2mol的电子转移
难度: 简单查看答案及解析
-
在1L某混合溶液中,H2SO4、FeSO4、Fe2(SO4)3物质的量浓度相等,其中SO42-的物质的量浓度为5.0 mol·L-1。该溶液最多能溶解铁粉的质量为( )。
A.28g B.56g C.78g D.112g
难度: 中等查看答案及解析
-
自然界的氮循环如下图所示,下列说法不正确的是( )

A.①中N2与O2反应生成NO
B.②中合成氨属于人工固氮
C.③中氮元素只被氧化
D.氧元素参与了氮循环
难度: 简单查看答案及解析
-
NA表示阿伏伽德罗常数,下列判断正确的是( )
A.NA个O2和28g N2所占的体积都约为22.4 L
B.标准状况下,22.4 L H2O含有NA个水分子
C.71g Cl2与足量NaOH溶液反应,转移的电子数为2NA
D.1.8g的NH4+ 离子中含有的电子数NA
难度: 简单查看答案及解析
-
溶洞中溶有碳酸氢钙的水,当从洞顶向洞底滴落时,水分的蒸发、压强的减小及温度的升高都会析出碳酸钙沉淀。下列实验不能实现碳酸氢钙转化为碳酸钙的是( )
A.
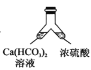 B.
B.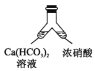 C.
C.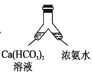 D.
D.
难度: 简单查看答案及解析
-
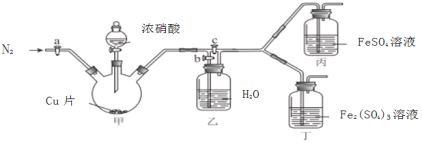
某化学兴趣小组为了制取并探究氨气的性质,按下图装置进行实验,制取氨气的原理:2NH4Cl+Ca(OH)2
CaCl2+2NH3↑+2H2O,下列说法不正确的是( )

A.装置B中的干燥剂可以是P2O5 B.装置C中的试纸不变色,D中试纸变蓝色
C.在装置E中滴入几滴浓盐酸会出现白烟 D.装置F中的漏斗能起防倒吸作用
难度: 简单查看答案及解析