-
25℃时,将稀氨水逐滴加入到稀硫酸中,当溶液的pH=7时,下列关系正确的是( )
A.c(NH4+)=c(SO42﹣) B.c(NH4+)=2c(SO42﹣)
C.2c(NH4+)=c(SO42﹣) D.c(OH﹣)+c(SO42﹣)=c(H+)+c(NH4+)
难度: 简单查看答案及解析
-
已知部分弱酸的电离平衡常数如表所示:
弱酸
醋酸
次氯酸
碳酸
亚硫酸
电离平衡常数(25 ℃)
Ka=1.75×10-5
Ka=2.98×10-8
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=1.54×10-2
Ka2=1.02×10-7
下列离子方程式正确的是
A.少量CO2通入NaClO溶液中:CO2+H2O+2ClO-=CO32-+2HClO
B.少量的SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.少量的SO2通入Na2CO3溶液中:SO2+H2O+2CO32-=SO32-+2HCO3-
D.相同浓度NaHCO3溶液与NaHSO3溶液等体积混合:H++HCO3-=CO2↑+H2O
难度: 中等查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入固体NaOH:c(Na+) = c(Cl-) + c(ClO-) + c(OH‑)
B.pH = 8.3的NaHCO3溶液:c(Na+) > c(HCO3-) > c(CO32-) > c(H2CO3)
C.pH = 11的氨水与pH = 3的盐酸等体积混合:c(Cl-) = c(NH4+) > c(OH‑) = c(H+)
D.0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+) – 2c(OH-) = c(CH3COO-) – c(CH3COOH)
难度: 简单查看答案及解析
-
下列过程或现象与盐类水解无关的是
A.纯碱溶液去油污 B.铁在潮湿的环境下生锈
C.加热氯化铁溶液颜色变深 D.泡沫灭火器灭火
难度: 中等查看答案及解析
-
某种碳酸饮料中主要含柠檬酸、碳酸、白砂糖、苯甲酸钠等成分,常温下测得其pH约为3.5,下列说法不正确的是
A.常温下,该碳酸饮料中KW的值大于纯水中KW的值
B.柠檬酸的电离会抑制碳酸的电离
C.该碳酸饮料中水的电离受到抑制
D.打开瓶盖冒出大量气泡,是因为压强减小,降低了CO2的溶解度
难度: 中等查看答案及解析
-
稀氨水中存在着下列平衡:NH3·H2O
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是
①NH4Cl固体;②硫酸;③NaOH固体;④水;⑤加热;⑥加入少量MgSO4固体。
A.①②③ B.③⑥ C.③ D.③⑤
难度: 中等查看答案及解析
-
25 ℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=7的溶液中:K+、Fe3+、Cl-、NO3-
B.c(OH-)=1.0×10-11mol/L的溶液中:Na+、Fe3+、Cl-、NO3-
C.含“84”消毒夜(有效成分NaClO)的溶液中:Fe2+、Cl-、Ca2+、Na+
D.由水电离产生的c(H+)=1.0×10-13mol/L的溶液中:Na+、AlO2-、NO3-、Cl-
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 已知2C(s)+2O2(g) == 2CO2(g) ΔH1, 2C(s)+O2(g)==2CO(g) ΔH2,则ΔH1<ΔH2
C. 已知H+(aq)+OH-(aq) == H2O(l) ΔH=-57.3kJ·mol-1,则任何酸碱中和反应的热效应数值均为57.3kJ
D. 已知C(石墨,s) == C(金刚石,s) ΔH>0,则金刚石比石墨稳定
难度: 中等查看答案及解析
-
广义的水解观认为:无论是盐的水解还是非盐的水解,其最终结果是反应中各物质和水分别解离成两部分,然后两两重新组合成新的物质。根据上述观点,下列说法不正确的是
A.CaO2的水解产物是Ca(OH) 2和H2O2
B.NaClO的水解产物之一是HClO
C.PCl3的水解产物是PH3和HClO
D.Mg3N2水解生成NH3和Mg(OH)2
难度: 中等查看答案及解析
-
25℃时,浓度均为1 mol/L的AX、BX、AY、BY四种正盐溶液,AX溶液的pH=7且溶液中c(X-)=1 mol/L,BX溶液的pH=4,BY溶液的pH=6。下列说法正确的是
A. AY溶液的pH小于7
B. AY溶液的pH小于BY溶液的pH
C. 稀释相同倍数,BX溶液的pH变化小于BY溶液
D. 电离平衡常数K(BOH)小于K(HY)
难度: 中等查看答案及解析
-
常温下,将a mL b mol/L CH3COOH溶液加入到c mL d mol/L NaOH溶液中。下列结论中,不正确的是
A.如果ab=cd,则反应后溶液的pH>7
B.如果a=c,且反应后溶液的pH<7,则b<d
C.如果a=c、b=d,则反应后的溶液中c(CH3COO—)<c(Na+)
D.如果反应后溶液的pH=7,则此溶液中c(CH3COO—)=c(Na+)
难度: 中等查看答案及解析
-
298K时,向体积均为15.0mL,浓度均为1.00mol/L的氨水和NaHCO3溶液中分别滴加1.00mol/L的盐酸,溶液的pH与所加盐酸体积的关系如图所示。下列有关叙述正确的是
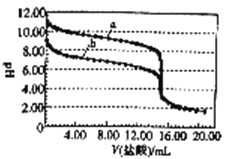
A.曲线a是NaHCO3溶液的滴定曲线
B.当V(盐酸)=4.00mL时,c(HCO3-)>c(NH4+)>c(CO32-)
C.当V(盐酸)=15.00mL时,c(Na+)=c(NH4+)
D.两个滴定过程均可选择酚酞作指示剂
难度: 中等查看答案及解析
-
298K时,向20mL0.1mol·L-1MOH溶液中滴加0.1mol·L-1CH3COOH溶液,所得溶液的pH及导电能力变化如图所示。下列叙述正确的是( )
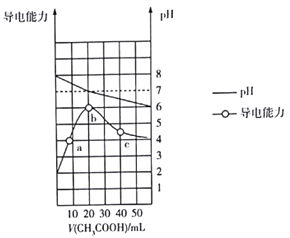
A. MOH是强电解质 B. b点对应的盐不水解
C. 水的离子积Kw:b>c>a D. c点溶液中c(CH3COO-)>c(M+)>c(H+)>c(OH-)
难度: 困难查看答案及解析
-
25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/LHCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
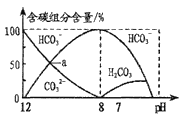
下列说法正确的是
A.在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B.a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C.当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D.当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
难度: 中等查看答案及解析
-
能够使CH3COONa溶液pH增大且水解程度减小的条件是
A.加水 B.升温 C.加压 D.加CH3COONa固体
难度: 简单查看答案及解析
-
将BaO2放入密闭的真空容器中,2BaO2(s) ⇋2BaO(s)+O2(g) 反应达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量不变
难度: 中等查看答案及解析
-
为达到预期的实验目的,下列操作中正确的是
A.用玻璃棒蘸取待测液滴在润湿的pH试纸上,测得其pH为12
B.制FeCl3溶液时,将FeCl3固体溶于盐酸中,然后再用水稀释到所需的浓度
C.中和热测定的实验中使用的玻璃仪器只有2种
D.在滴定时,左手操作锥形瓶,右手操作滴定管开关
难度: 中等查看答案及解析
-
二氧化钛在一定波长光的照射下,可有效降解甲醛、苯等有机物,效果持久,且自身对人体无害。某课题组研究了溶液的酸碱性对TiO2光催化染料R降解反应的影响,结果如图所示。下列判断正确的是
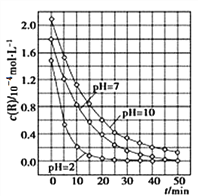
A. 在0~50 min之间,R的降解百分率pH=2大于pH=7
B. 溶液酸性越强,R的降解速率越大
C. R的起始浓度不同,无法判断溶液的酸碱性对R的降解速率的影响
D. 在20~25 min之间,pH=10时R的降解速率为0.04 mol·L-1·min-1
难度: 困难查看答案及解析
-
甲、乙、丙三个容器中最初存在的物质及其数量如图所示,三个容器最初的容积相等、温度相同,反应中甲、丙的容积不变,乙中的压强不变,在一定温度下反应达到平衡。下列说法正确的是
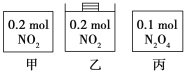
A.平衡时各容器内c(NO2)的大小顺序为乙>甲>丙
B.平衡时N2O4的百分含量:乙>甲=丙
C.平衡时甲中NO2与丙中N2O4的转化率不可能相同
D.平衡时混合物的平均相对分子质量:甲>乙>丙
难度: 困难查看答案及解析