-
2017年1月,南京理工大学胡炳成教授团队成功合成世界首个全氮阴离子盐,全氮阴离子化学式为N5-。下列关于全氮阴离子盐的说法正确的是
A. 每个N5-含有26个电子
B. N5-的摩尔质量为71g·mol-1
C. 全氮阴离子盐既含离子键又含共价键
D. 全氮阴离子盐可能属于电解质,也可能属于非电解质
难度: 中等查看答案及解析
-
类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否。下列几种类推结论中,你认为正确的是( )
A.沸点HBr>HCl,则同族元素氢化物沸点HCl>HF
B.Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3
C.CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2
D.惰性电极电解硫酸溶液后,加水可以使电解质溶液完全恢复。则用惰性电极电解硫酸钠溶液后加水也可以使电解质溶液完全恢复
难度: 中等查看答案及解析
-
人们的生活离不开化学,学好化学可以更好地服务社会。下列说法中不正确的是( )
A.可用臭氧代替农药在粮食仓储中杀菌防霉,因为臭氧具有强氧化性
B.日常生活中,我们常用小苏打、苏打作食用碱,食盐作调味剂、食品防腐剂
C.酱油中加入氯化亚铁可以治疗缺铁性贫血
D.我国古时镀金“以汞和金涂银器上,成白色,入火则汞去,而金存,数次即黄。”其中“入火则汞去”是指升华
难度: 中等查看答案及解析
-
下列有关化学用语表示正确的是( )
A.CO2的比例模型:
B.H和Cl形成共价键的过程:

C.CH2F2的电子式:
D.HClO的结构式:H-O-Cl
难度: 中等查看答案及解析
-
下列关于阿伏加德罗常数NA的说法正确的是( )
A.标况下11.2LHCl气体溶于0.5L水中,所得溶液中含Cl- 数目为NA
B.NA个Fe(OH)3胶体粒子的质量为107g
C.20gD2O和H218O中含有的质子数为10NA
D.在电解精炼铜过程中转移了NA 个电子,阳极溶解了32g铜
难度: 中等查看答案及解析
-
如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是( )
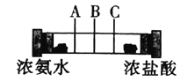
A.玻璃管中发生的反应可表示为:NH3+HCl=NH4Cl
B.用手触摸玻璃管外壁,会感觉到有热量放出
C.实验时会在玻璃管的B处附近看到白雾
D.将浓盐酸换成浓硝酸也会有相似现象
难度: 中等查看答案及解析
-
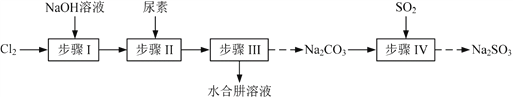
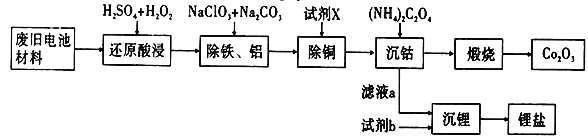
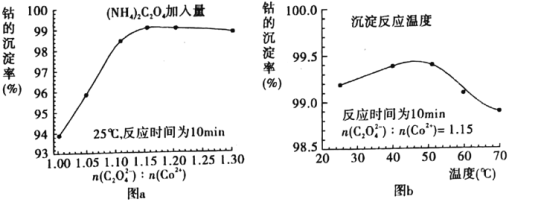
实验室模拟工业漂白液(有效成分为NaClO)脱除废水中氨氮(NH3)的流程如下:
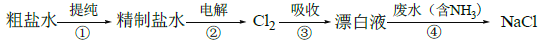
下列分析正确的是
A. ①中采用蒸馏的方法精制粗盐水
B. ②中阳极的主要电极反应:4OH- - 4e- = 2H2O + O2↑
C. ③中制备漂白液的反应:Cl2 + OH- = Cl- + HClO
D. ②、③、④中均发生了氧化还原反应
难度: 中等查看答案及解析
-
向BaCl2溶液中通入物质的量之比为1∶2的某混合气体,无沉淀产生,则该混合气体是( )
A.Cl2和SO2 B.CO2和NH3 C.NO和CO2 D.NO2和SO2
难度: 中等查看答案及解析
-
对于下列实验事实的解释,不合理的是( )
选项
实验事实
解释
A
加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体
H2SO4不易挥发,HCl易挥发
B
电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na
得电子能力:Cu2+>H+>Na+
C
浓HNO3能氧化NO;稀HNO3不能氧化NO
HNO3浓度越大,氧化性越强
D
用浓盐酸和石灰石反应产生的气体通入Na2SiO3溶液中,Na2SiO3溶液变浑浊
C元素的非金属性大于Si元素
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列物质性质与应用的因果关系正确的是( )
A.大气中的N2可作为工业制硝酸的原料
B.晶体硅用于制作半导体材料是因其熔点高、硬度大
C.Fe2+、SO2都能使酸性高锰酸钾溶液褪色,前者表现出还原性后者表现出漂白性
D.氯气泄漏现场自救方法是用湿毛巾捂住口鼻并向地势低的地方撤离
难度: 简单查看答案及解析
-
港珠澳大桥的设计使用寿命高达120年,主要的防腐方法有:①钢梁上安装铝片;②使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是( )
A.防腐涂料可以防水、隔离O2,降低吸氧腐蚀速率
B.防腐过程中铝和锌均作为牺牲阳极,失去电子
C.方法①②③只能减缓钢铁腐蚀,未能完全消除
D.钢铁发生吸氧腐蚀时的正极反应式为:O2- 4e- + 2H2O =4 OH-
难度: 中等查看答案及解析
-
最近有科学家发现正丁烷(
)脱氢或不完全氧化也可制得1,3-丁二烯(
),已知热化学方程式如下:( )
①
=
②
=
③
=
下列说法正确的是( )
A.由②可知,正丁烷(
)的燃烧热为
B.由①和②可推知:
=
C.
=
D.由①和②可知,同质量的正丁烷(
)转变为1,3-丁二烯(
)所需要的能量相同
难度: 中等查看答案及解析
-
短周期元素A、B、C、D、E在元素周期表中的相对位置如图所示,其中D原子的质子数是其M层电子数的三倍,下列说法正确的是( )
A.A的氢化物沸点比D的高,因为A的氢化物分子内存在氢键
B.工业上常用C与E形成的化合物来获得C的单质
C.简单离子的半径由大到小为:E>A>B>C
D.D、E两元素形成的化合物每种原子最外层一定都达到了8e-稳定结构
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g) △H=-a kJ·mol-1已知:下列说法正确的是( )
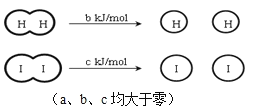
A.H2、I2和HI分子中的化学键都是非极性共价键
B.相同条件下,1 mol H2(g)和1 mol I2(g)的总能量小于2 mol HI(g)的总能量
C.断开2 mol HI分子中的化学键所需能量约为(c+b+a)kJ
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
难度: 简单查看答案及解析
-
利用微生物燃料电池原理,可以处理宇航员排出的粪便,同时得到电能。美国宇航局设计的方案是:用微生物中的芽孢杆菌来处理粪便产生氨气,氨气与氧气分别通入燃料电池两极,最终生成常见的无毒物质。示意图如下所示。下列说法错误的是( )
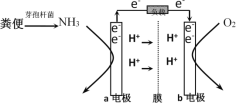
A.a电极是负极,b电极是正极
B.负极区发生的反应是2NH3 - 6e-=N2+6H+
C.正极区,每消耗标准状况下2.24 L O2,a向b电极转移0.4 mol电子
D.电池工作时电子通过由a经负载流向b电极,再穿过离子交换膜回到a电极
难度: 简单查看答案及解析
-
臭氧有很多实用特性,其强氧化性常用于消毒杀菌和防腐保鲜。目前制取臭氧的方法很多,其中电晕放电法(DBD)和电解纯水法原理如图所示。下列说法中错误的是( )
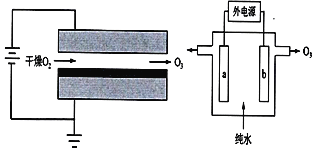
A.两种方法都是将电能转化为化学能
B.电解纯水时,阳极发生的电极反应有3H2O-6e-=O3↑+6H+
C.电晕放电法和电解纯水法相比,会产生污染性的NOx气体
D.电解纯水时,H+由电极b流向电极a
难度: 中等查看答案及解析