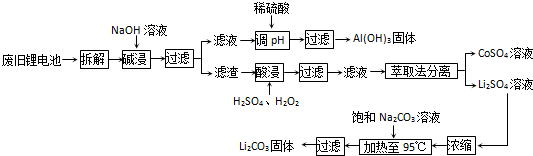
-
1,5-戊二醛(简称GA),是一种重要的饱和直链二元醛.2%的GA溶液具有广谱、高效、无刺激性、无腐蚀等特点,对禽流感、猪流感等疾病有良好的防治作用.根据上述信息,判断下列说法正确的是( )
A.戊二醛分子式是C5H10O2,符合此分子式的二元醛有4种
B.戊二醛不能在加热条件下和新制的氢氧化铜悬浊液反应
C.戊二醛不能使酸性高锰酸钾溶液褪色
D.2%的GA溶液能破坏菌体蛋白质,杀死微生物,具有消毒杀菌作用难度: 中等查看答案及解析
-
查阅资料发现,金属钠不仅能跟氧气和水反应,还能跟多种其他物质发生反应,其中包括与酒精在常温下反应.要研究金属钠跟酒精反应的性质以及它与金属钠跟水反应的异同点,下列研究方法中用不到的是( )
A.实验法
B.观察法
C.分类法
D.比较法难度: 中等查看答案及解析
-
在陆地生态系统研究中,2H、13C、15N、18O、34S等常用作环境分析指示物.下列说法正确的是( )
A.34S原子核内中子数为16
B.在相同条件下1H216O比1H218O更易挥发
C.13C和15N原子核内的质子数相差2
D.2H+的酸性比1H+的酸性更强难度: 中等查看答案及解析
-
下列说法正确的是( )
A.乙酸、葡萄糖、淀粉的最简式均为CH2O
B.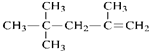 的名称为:2,2,4-三甲基-4-戊烯
的名称为:2,2,4-三甲基-4-戊烯
C.PCl3、H2O2、COCl2三种分子中所有原子均满足最外层8电子结构
D.NaHSO4在熔融状态下的电离方程式为:NaHSO4→Na++HSO4-难度: 中等查看答案及解析
-
下列有关实验的现象描述正确的是( )
A.氢气在氯气中安静的燃烧,火焰呈苍白色,瓶口有白雾产生
B.硫在空气中燃烧,发出明亮的蓝紫色火焰,产生有刺激性气味的气体
C.铜在氯气中燃烧,产生白烟,加水溶解后可能得到绿色溶液
D.用洁净的玻璃棒蘸取碳酸钾粉末在酒精灯火焰上灼烧,可观察到明亮的紫色火焰难度: 中等查看答案及解析
-
根据中学化学教材所附元素周期表判断,下列叙述正确的是( )
A.L电子层电子数为奇数的所有元素都是非金属
B.第三、四、五、六周期元素的数目分别是8、18、32、32
C.由左至右第8、9、10三列元素中没有非金属元素
D.只有第ⅡA族元素的原子最外层有2个电子难度: 中等查看答案及解析
-
据悉,2010年田径世锦赛上使用的发令枪所用的“火药”成分是氯酸钾和红磷,经撞击发出响声,同时产生白色烟雾.撞击时发生的化学方程式为:5KClO3+6P→3P2O5+5KCl,则下列有关叙述错误的是( )
A.上述反应中氧化剂和还原剂的物质的量之比为5:6
B.产生白色烟雾的原因是生成的P2O5白色固体小颗粒(烟)吸水性很强,吸收空气中的水分,生成磷酸小液滴(雾)
C.上述反应中消耗3 mol P时,转移电子的物质的量为15mol
D.因红磷和白磷互为同分异构体,所以上述火药中的红磷可以用白磷代替难度: 中等查看答案及解析
-
下列化学实验事实及其结论都正确的是( )
A.铝箔在酒精灯火焰上加热熔化但不滴落,说明铝箔表面氧化铝熔点高于铝
B.将SO2通入含HClO的溶液中,生成H2SO4,说明HClO酸性比H2SO4 强
C.FeCl3溶液可以腐蚀线路板上的Cu,说明Fe的金属活动性大于Cu
D.将饱和氯水滴到淀粉碘化钾试纸上,试纸先变蓝后变白,说明氯水具有漂白性难度: 中等查看答案及解析
-
只给出下列甲和乙中对应的量,可以组成一个有关(或含有)物质的量的公式( )
① ② ③ ④ ⑤ 甲 物质微粒数 标准状况下的气体摩尔体积 固体体积 非标准状况下物质质量 溶液质量分数 乙 阿伏伽德罗常数 标准状况下的气体体积 固体密度 物质的摩尔质量 溶液体积
A.①②
B.①②④
C.①②③
D.①②⑤难度: 中等查看答案及解析
-
在体积可变的密闭容器中建立氨气在水中的溶解平衡和电离平衡,在如图的容器中按图示操作,下列各项叙述正确的是( )

A.氨水的浓度增大,pH减小
B.液面上氨气的压强不变,水溶液的pH不变
C.液面上氨气的压强增大,溶液的浓度增大,pH变大
D.液面上氨气的压强变大,溶液的浓度增大,NH3•H2O电离程度变大难度: 中等查看答案及解析
-
下列各组离子能在指定溶液中大量共存的是( )
A.在能使石蕊试纸变蓝色的溶液中:Na+,AlO2-,S2-,SO42-
B.由水电离的H+浓度c(H+)=10-12mol•L-1的溶液中:Cl-,CO32-,NH4+,SO32-
C.在加入铝粉能产生H2的溶液中:NH4+、Na+、Fe2+、NO3-
D.pH=2的溶液中:Na+、SO42-、NO3-、AlO2-难度: 中等查看答案及解析
-
下列离子方程式正确的是( )
A.向Mg(HC03)2溶液中加入过量的NaOH溶液:Mg2++2HC03-+20H-═MgC03↓+C032-+2H2
B.向NH4Al(S04)2溶液中滴入Ba(OH)2溶液使SO42-反应完全:2Ba2++40H-+Al3++2SO42-═2BaS04↓+Al02-+2H2
C.足够的C02通入饱和碳酸钠溶液中:C02+CO32-+H20=2HC03-
D.向Fe(N03)2溶液中加入稀盐酸:3Fe2++4H++N03-═3Fe3++NO↑+2H2难度: 中等查看答案及解析
-
据美国《科学》杂志报道,外太空的某个星球的大气层中含有大量的CH2=CHOH,此物质常温下为液体,不稳定,易转化为CH3CHO,方程式为CH2=CHOH→CH3CHO+Q(Q>0).据此,以下叙述中不正确的是 ( )
A.该星球表面温度很低
B.低温下稳定性:CH2=CHOH<CH3CHO
C.该星球表面温度很高
D.高温下稳定性:CH2=CHOH>CH3CHO难度: 中等查看答案及解析
-
化学反应经常伴随着颜色变化,下列有关反应获得的颜色正确的是( )
①二氧化硫通入品红溶液→无色 ②淀粉溶液遇单质碘→蓝色
③溴化银见光分解→银白色 ④热的氧化铜遇乙醇→绿色
⑤用标准氢氧化钠溶液滴定含酚酞指示剂的盐酸,终点时溶液无色→粉红色
⑥苯酚在空气中氧化→粉红色.
A.①②③⑤
B.①②⑤⑥
C.②④⑥
D.②③⑥难度: 中等查看答案及解析
-
下列实验装置设计正确,且能达到目的是( )
A.
测定乙醇结构式
B.
合成氨并检验氨的生成
C.
碘的CCl4溶液中分离I2,并回收CCl4
D.
配制稀硫酸溶液难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数,下列说法正确的是( )
A.1 L 0.1 mol/L Na2CO3溶液中CO32-和HCO3-总数为0.1 NA
B.22.4L氢气和4g氦气均含有NA个分子
C.125mL16mol/L浓硫酸与足量的铜反应,生成SO2的分子数小于NA
D.0.1mol铁与0.1molCl2充分反应,转移的电子数为0.3NA难度: 中等查看答案及解析
-
已知氯化铁溶液中通入硫化氢可发生反应:2FeCl3+H2S→2FeCl2+S↓+2HCl.在标准状况下,向100mLFeCl3溶液中通入a L的H2S气体恰好反应后,再加入足量的铁粉充分反应.所得溶液经测定金属阳离子的浓度为3mol/L,若反应过程中溶液体积不变,则原FeCl3溶液的物质的量浓度为( )
A.1.5mol/L
B.2 mol/L
C.1 mol/L
D.无法确定难度: 中等查看答案及解析
-
下列关于化工生产原理的叙述中,均符合目前工业生产实际的是( )
A.氯碱工业中,氢氧化钠在电解槽的阴极区产生
B.氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸
C.合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率
D.二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸难度: 中等查看答案及解析
-
化学中常用图象直观地描述化学反应的进程或结果.下列图象描述正确的是( )
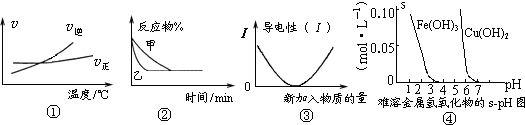
A.根据图①可判断可逆反应“A2(g)+3B2(g)⇌2AB3(g)”的△H>0
B.图②表示压强对可逆反应2A(g)+2B(g)⇌3C(g)+D(s)的影响,乙的压强大
C.图③可表示乙酸溶液中通入氨气至过量过程中溶液导电性的变化
D.根据图④,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO,至pH在4左右难度: 中等查看答案及解析
-
下列溶液中,各关系式正确的是( )
A.等浓度、等体积的NaOH 和二元弱酸H2A 混和溶液中:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
B.1 L 0.1 mol•L-1 CuSO4•(NH4)2SO4•6H2O 的溶液中:c(SO42-)>c(NH4+)>c(Cu2+)>c(H+)>c(OH-)
C.已知两种弱酸HA、HB 的电离平衡常数Ka(HA)>Ka(HB),常温下0.1 mol•L-1的HA、HB、NaA、NaB 溶液中:pH(NaA)>pH(NaB)>pH(HA)>pH(HB)
D.物质的量浓度相等的Na2CO3 和NaHCO3 溶液等体积混合后的溶液中:3c(H2CO3)+2c(H+)+c(HCO3-)=2c(OH-)+c(CO32-)难度: 中等查看答案及解析
-
青石棉(cricidolite)是世界卫生组织确认的一种致癌物质,是《鹿特丹公约》中受限制的46种化学品之一,青石棉的化学式为:Na2Fe5Si8O22(OH)2,青石棉用稀硝酸溶液处理时,还原产物只有NO,下列说法正确的是( )
A.青石棉是一种易燃品且易溶于水
B.青石棉的化学组成用氧化物的形式可表示为:Na2O•3FeO•Fe2O3•8SiO2•H2O
C.1mol Na2Fe5Si8O22(OH)2与足量的硝酸作用,至少需消耗6L 3mol/L HNO3溶液
D.1mol Na2Fe5Si8O22(OH)2与足量氢氟酸作用,至少需消耗5.5L 2mol/L HF溶液难度: 中等查看答案及解析
-
某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等):
则下列分析推理中不正确的是( )50mL盐酸 50mL盐酸 50mL盐酸 m(混合物) 9.2g 15.7g 27.6g V(CO2)(标况) 2.24L 3.36L 3.36L
A.根据表中数据不能计算出混合物中NaHCO3的
B.加入混合物9.2 g时盐酸过量
C.盐酸的物质的量浓度为3.0 mol•L-1
D.15.7 g混合物恰好与盐酸完全反应难度: 中等查看答案及解析
 ______
______

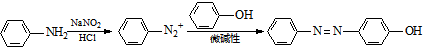

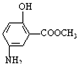 )也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子.X的结构简式为______.
)也可用于合成奥沙拉秦.它的一种同分异构体X是α-氨基酸,能与FeCl3发生显色反应,其分子中共有6种化学环境不同的H原子.X的结构简式为______.