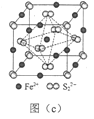
-
只有阳离子而没有阴离子的晶体是
A. 金属晶体 B. 原子晶体 C. 分子晶体 D. 无法判断
难度: 中等查看答案及解析
-
下列说法不正确的是
A. SiO2、SiCl4的相对分子质量不同,所以沸点不同
B. NH4C1与NaOH所含化学键类型和晶体类型均相同
C. PCl3、H2O中所有原子均处于稳定结构
D. CO2与水反应过程中,有共价键的断裂和形成
难度: 中等查看答案及解析
-
下列四种元素中,其单质氧化性最强的是
A. 原子含有未成对电子最多的第2周期元素
B. 位于周期表第3周期ⅢA族的元素
C. 原子最外电子层排布式为3s23p5的元素
D. 原子最外电子层排布式为2s22p6的元素
难度: 中等查看答案及解析
-
当原子数目与电子数目分别相等的微粒叫“等电子体”,下列各组微粒间属于等电子体的是
A. CH4和NH3 B. H2O和CO2
C. CO2和HCl D. H3O+和NH3
难度: 简单查看答案及解析
-
对核外电子运动状态的描述,较为全面的是
A. 结构示意图 B. 电子式 C. 电子排布式 D. 轨道表达式
难度: 简单查看答案及解析
-
下列说法和解释错误的是( )
A. 冰融化时,需破坏晶体中的全部氢键,所以冰融化时密度变大
B. 卤化物CX4从F到I,由于分子量增大,分子间范德华力增大,熔沸点也逐渐升高
C. 由于石墨晶体中层间距较远,电子不易实现迁移,所以石墨的导电性只能沿石墨平面的方向
D. 金属中的“电子气”在电场中可以定向移动,所以金属具有良好的导电性。
难度: 中等查看答案及解析
-
下列说法中,不正确的是( )
A. 光谱分析可用于元素检测,稀有气体He就是在分析太阳光谱时发现的
B. X射线衍射实验是区别晶体与非晶体的最科学的方法
C. 等电子体具有相同的价电子总数,导致它们具有相同的化学性质
D. 分子中只含极性键的分子不一定是极性分子。
难度: 中等查看答案及解析
-
若某原子在处于能量最低状态时,外围电子排布为4d15s2,则下列说法错误的是
A.该元素可能有+3价
B.该元素位于第5周期副族
C.该元素原子核外共有38个不同运动状态的电子
D.该元素基态原子第N能层上还有4个空轨道
难度: 简单查看答案及解析
-
下列现象与氢键有关的是
①NH3的熔、沸点比PH3的高
②乙醇能与水以任意比混溶,而甲醚(CH3—O—CH3)难溶于水
③冰的密度比液态水的密度小
④邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低
⑤水分子高温下也很稳定
A.①②③④ B.①②③⑤ C.②③④⑤ D.①④⑤
难度: 中等查看答案及解析
-
共价键、离子键、范德华力和氢键都是微观粒子之间的不同作用力。有下列物质:①Na2O2 ②冰 ③金刚石 ④碘单质 ⑤CaCl2 ⑥白磷,只含有两种作用力是( )
A.①④⑥ B.①③⑥ C.②④⑤ D.①②③⑤
难度: 中等查看答案及解析
-
下列各组分子中,都属于含极性键的非极性分子的是 ( )
A. CO2 H2S B. C2H4 CH4
C. C60 C2H4 D. NH3 HCl
难度: 中等查看答案及解析
-
下列各组晶体物质中,化学键类型相同,晶体类型也相同的是 ( )
①SiO2和SO3 ②晶体硼和HCl ③CO2和SO2 ④晶体硅和金刚石 ⑤晶体氖和晶体氮 ⑥硫黄和碘
A.①②③ B.④⑤⑥ C.③④⑥ D.①③⑤
难度: 中等查看答案及解析
-
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。
则下列有关比较中正确的是
A.原子半径:③>④>②>①
B.第一电离能:④>③>②>①
C.最高正化合价:③>④=②>①
D.电负性:④>③>②>①
难度: 中等查看答案及解析
-
2017年5月9日中国科学院正式向社会发布113号、115号、117号和118号元素的中文名称。已知117号元素有多种原子,如
、
等。下列说法正确的是
A.
和
的化学性质完全不同
B. 元素Ts的相对原子质量为
C. 基态
原子核外电子共占据7个能级
D. Ts位于周期表的第七周期ⅦA族
难度: 中等查看答案及解析
-
下列关于元素性质的有关叙述中不正确的是
A.C、N、O、F的原子半径依次减小
B.KOH、NaOH、LiOH的碱性逐渐减弱
C.P、S、Cl、Ar的最高正价依次升高
D.Na、Mg、Al、Si的最外层电子数依次增加
难度: 简单查看答案及解析
-
下列各组元素属于p区的是( )
A. 原子序数为1、2、7的元素 B. S、O、P C. Fe、Ar、Cl D. Na、Li、Mg
难度: 中等查看答案及解析
-
能说明BF3分子中四个原子在同一平面的理由是
A.三个B―F键的键能相同 B.B―F键是非极性共价键
C.任意两个键的夹角为120° D.三个B―F键的键长相等
难度: 简单查看答案及解析
-
Q、X、Y、Z是原子序数依次增大的短周期主族元素,Q原子的最外层电子数是内层电子数的2倍,X、Y、Z在周期表中的位置关系如图所示。下列说法正确的是( )
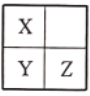
A.Q和Z可能形成化合物QZ2
B.Y的最高价氧化物的水化物一定是强酸
C.X、Z和氢三种元素不可能组成离子化合物
D.最简单气态氢化物的沸点:Q>X
难度: 中等查看答案及解析
-
下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性
②含有金属阳离子的晶体一定是离子晶体
③共价键可决定分子晶体的熔、沸点
④MgO的晶格能远比NaCl大,这是因为前者离子所带的电荷数多,离子半径小
⑤晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
⑥晶体尽可能采取紧密堆积方式,以使其变得比较稳定,
⑦干冰晶体中,一个CO2分子周围有12个CO2分子紧邻;钠晶体中,一个钠原子周围也有12个钠原子紧邻
A.①②③ B.②③④ C.④⑤⑥ D.②③⑦
难度: 简单查看答案及解析
-
二氧化硅晶体是立体的网状结构,其结构如图所示。关于二氧化硅的下列说法中,不正确的是( )
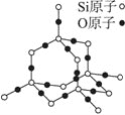
A. 晶体中Si、O原子个数比为1∶2
B. 晶体中最小原子环上的原子数为8
C. 晶体中最小原子环上的原子数为12
D. 晶体中Si、O原子最外层都满足8电子稳定结构
难度: 中等查看答案及解析
-
下列物质:①H3O+ ②[B(OH)4]- ③CH3COO- ④NH3 ⑤CH4中存在配位键的是
A.①② B.①③ C.④⑤ D.②④
难度: 简单查看答案及解析
-
下列物质属于分子晶体的是
A.CaO B.CO2 C.SiO2 D.NaCl
难度: 简单查看答案及解析
-
元素原子的核外电子排布决定了元素在元素周期表中的位置,已知某元素原子的核外电子排布式为1s22s22p63s23p63d34s2。该元素位于元素周期表
A.第四周期第ⅤB族 B.第四周期第ⅡA族
C.第二周期第ⅡB族 D.第五周期第ⅡB族
难度: 简单查看答案及解析
-
将等物质的量的硫酸和氢氧化钠反应后所得到的溶液蒸干,可得到NaHSO4。下列关于NaHSO4的说法正确的是
A.因为NaHSO4是离子化合物,所以NaHSO4固体能够导电
B.NaHSO4固体中阳离子和阴离子的个数比是2∶1
C.NaHSO4固体熔化时破坏的是离子键和共价键
D.NaHSO4固体溶于水时破坏的是离子键和共价键
难度: 简单查看答案及解析
-
氢元素与其他元素形成的二元化合物称为氢化物,有关氢化物的叙述正确的是
A. HF的电子式为
B. H2O的空间构型为直线型
C. NH3的结构式为
D. CH4的比例模型为
难度: 简单查看答案及解析
-
石墨晶体是层状结构,在每一层内,每一个碳原子都跟其他3个碳原子相结合。据图分析,石墨晶体中碳原子数与共价键数之比为( )
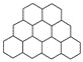
A.2∶3 B.2∶1 C.1∶3 D.3∶2
难度: 简单查看答案及解析
-
下列关于配位化合物的叙述中,不正确的是( )
A. 配位化合物中必定存在配位键,可能存在极性键
B. 配位化合物中只有配位键
C. [Cu(H2O)6]2+中的Cu2+提供空轨道,H2O中的氧原子提供孤对电子形成配位键
D. 配位化合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有着广泛的应用
难度: 简单查看答案及解析
-
下列分子中的立体结构模型正确的是
A. CO2的立体结构模型
B. H2O的立体结构模型
C. NH3的立体结构模型
D. CH4的立体结构模型
难度: 简单查看答案及解析