-
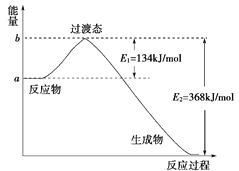
下列反应既是氧化还原反应又是放热反应的是( )
①过氧化钠与水反应 ②氨水与稀硫酸的反应
③灼热的炭与CO2反应④Ba(OH)2⋅8H2O与NH4Cl的反应
⑤甲烷在O2中的燃烧 ⑥灼热的炭与水蒸气反应
⑦铝片与稀硫酸反应 ⑧铝热反应
⑨煅烧石灰石制生石灰 ⑩钾与水的反应
A. ①⑤⑦⑧⑩ B. ①③⑤⑦⑩ C. ①②⑤⑦⑧⑩ D. ①③⑤⑥⑦⑩
难度: 中等查看答案及解析
-
下列说法不正确的是( )
①质子数相同的粒子一定是同种元素
②同位素的性质几乎相同
③质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子
④电子数相同的粒子不一定是同一种元素
⑤一种元素只能有一种质量数
⑥某种元素的相对原子质量取整数,就是其质量数
A. ②③⑤⑥ B. ①②④⑤ C. ①②⑤⑥ D. ③④⑤⑥
难度: 中等查看答案及解析
-
某元素R的原子结构示意图为
,下列关于该原子的说法正确的是( )
A.质子数为7 B.元素位于周期表中第三周期
C.核外电子数为7 D.最高价氧化物化学式为R7O2
难度: 中等查看答案及解析
-
下列关于元素周期表应用的说法正确的是( )
A.在过渡元素中,可以找到半导体材料
B.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
C.为元素性质的系统研究提供指导,为新元素的发现提供线索
D.在金属与非金属的交界处,寻找耐高温、耐腐蚀的合金材料
难度: 中等查看答案及解析
-
下列化学用语表示错误的是( )
A.HClO的电子式:
B.S2-的结构示意图:
C.过氧化钠的电子式为:Na+[ :O:: O: ]2-Na+
D.R2+离子核外有a个电子,b个中子,R原子表示为:
难度: 中等查看答案及解析
-
下列说法正确的是
A.元素周期表中元素排序的依据是元素的相对原子质量
B.元素周期表中元素排序的依据是原子的核电荷数
C.元素周期表有十六个纵行,也就是十六个族
D.元素周期表已发展成为一个稳定的形式,它不可能再有任何新的变化了
难度: 简单查看答案及解析
-
2016年IUPAC将合成化学元素第115号(Mc)提名为化学新元素,Mc的原子核最外层电子数是5,下列说法不正确的( )
A.Mc的原子核外有115个电子
B.Mc与N元素属于同一主族
C.Mc在同主族元素中金属性最强
D.中子数为173的Mc核素符号是
难度: 中等查看答案及解析
-
1919年,科学家实现了人类多年的梦想—人工转变元素。这个核反应如下:
,下列有关叙述正确的是( )
A.
原子核内有9个质子
B.通常情况下,He和N2化学性质都较稳定
C.
原子核内有1个中子
D.O2和O3互为同位素
难度: 简单查看答案及解析
-
不能说明氯的非金属性强于溴的事实是( )
A.HClO4酸性强于HBrO4 B.HBr的分解温度低于HCl
C.FeBr2溶液中滴少量氯水,溶液变黄 D.BrCl中氯为﹣1价
难度: 中等查看答案及解析
-
四种短周期元素X、Y、Z和M在周期表中的位置如图所示,Y原子序数是X的2倍。下列说法不正确的是
A. Z、M、X的简单离子半径依次减小
B. Y和M可形成离子化合物YM4
C. X的简单气态氢化物的稳定性强于Y的
D. M的最高价氧化物对应水化物的酸性比Z的强
难度: 中等查看答案及解析
-
下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
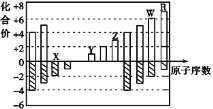
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
难度: 简单查看答案及解析
-
原子的核电荷数小于18的某元素X,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )
A.X能形成化学式为X(OH)3的碱 B.X能与某些金属元素形成化合物
C.X原子的最外层电子数和核电荷数肯定为奇数 D.X可能形成化学式为KXO3的盐
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 因为3O2==2O3是吸热反应,所以臭氧比氧气的化学性质更活泼
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
难度: 简单查看答案及解析
-
利用含碳化合物合成燃料是解决能源危机的重要方法,已知CO(g)+2H2(g)
CH3OH(g)反应过程中的能量变化情况如图所示,曲线Ⅰ和曲线Ⅱ分别表示不使用催化剂和使用催化剂的两种情况。下列判断正确的是( )
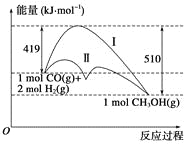
A.该反应的ΔH=+91 kJ·mol-1
B.加入催化剂,该反应的ΔH变小
C.反应物的总能量大于生成物的总能量
D.如果该反应生成液态CH3OH,则ΔH增大
难度: 中等查看答案及解析
-
HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1 B.-45.2 kJ·mol-1 C.+45.2 kJ·mol-1 D.+69.4 kJ·mol-1
难度: 简单查看答案及解析
-
已知化学反应:C(s)+
O2(g)=CO(g) ΔH1<0 CO(g)+
O2(g)=CO2(g) ΔH2<0 C(s)+O2(g)=CO2(g) ΔH3<0。相同条件下,下列说法正确的是( )
A.56 g CO和32 g O2所具有的总能量小于88 g CO2所具有的总能量
B.碳的燃烧热是|ΔH3|
C.ΔH1<ΔH3
D.28 g CO的总能量比44 g CO2的总能量高
难度: 中等查看答案及解析
-
以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+
O2(g) →2CO2(g)+H2O(l) ;ΔH=-1 300 kJ·mol-1的说法中,正确的是( )
A.当5NA个电子转移时,该反应放出1 300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1 300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1 300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1 300 kJ的能量
难度: 中等查看答案及解析
-
已知:①H2(g)+
O2(g)=H2O(g);ΔH1= akJ·mol-1
②2H2(g)+O2(g) = 2H2O(g);ΔH2= b kJ·mol-1 ③ H2(g)+
O2(g)=H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g) = 2H2O(l);ΔH4= d kJ·mol-1,下列关系式中正确的是( )
A.2a=b<0 B.b>d>0 C.a<c<0 D.2c=d>0
难度: 简单查看答案及解析
-
化学反应X2+3Y2=2XY3的能量变化如图所示,该反应的热化学方程式是( )
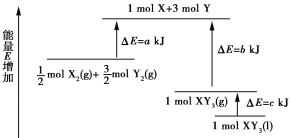
A.X2(g)+3Y2(g)=2XY3(l) ΔH =2(a−b−c) kJ/mol
B.X2(g)+3Y2(g)=2XY3(g) ΔH =2(b−a) kJ/mol
C.X2(g)+3Y2(g)=2XY3(l) ΔH =(b+c−a) kJ/mol
D.X2(g)+3Y2(g)=2XY3(g) ΔH =(a+b) kJ/mol
难度: 中等查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程的示意图如下:

下列说法正确的是
A. CO和O生成CO2是吸热反应
B. 在该过程中,CO断键形成C和O
C. 同物质的量的CO和O反应比CO与O2反应放出更多热量
D. 状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
难度: 困难查看答案及解析