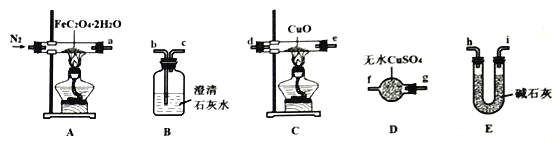
-
下列说法正确的是
A. 高级脂肪酸乙酯是生物柴油中的一种成分,它属于油脂
B. 天然纤维、聚酯纤维、光导纤维都属于有机高分子材料
C. 离子交换膜在工业上应用广泛,如在氯碱工业中使用的阴离子交换膜
D. 国产大客机C919大规模使用先进的材料铝锂合金,该合金密度小,强度高
难度: 中等查看答案及解析
-
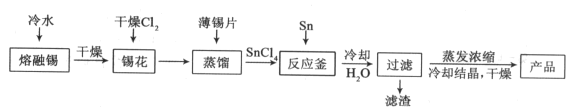
从废铅蓄电池铅膏(含PbSO4、PbO2和Pb等)中回收铅的一种工艺流程如下:

已知:浓硫酸不与PbO2反应,Ksp(PbCl2)=2.0×10-5,Ksp(PbSO4)=1.5×10-8,PbCl2(s)+2Cl-(aq)=PbCl42-(aq)。下列说法错误的是
A. 合理处理废铅蓄电池有利于资源再利用和防止重金属污染
B. 步骤①中可用浓硫酸代替浓盐酸
C. 步骤①、②、③中均涉及过滤操作
D. PbSO4(s)+2Cl-(aq)
PbCl2(s)+SO42-(aq)的平衡常数为7.5×10-4
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值。下列叙述正确的是
A. 标准状况下,22.4LCO和CO2的混合物中,含碳原子的数目为NA
B. 14g分子式为C5H10的烃中,含有的碳碳双键的数目为0.2NA
C. 0.1mol/L的CH3COONH4溶液中,含铵根离子数目小于0.1NA
D. 标准状况下2.24LCl2通入足量水中或NaOH溶液中,转移电子数目为0.1NA
难度: 中等查看答案及解析
-
依据反应2NaIO3+5SO2+4H2O=I2+3H2SO4+2NaHSO4,利用下列装置从含NaIO3的废液中制取单质碘的CCl4溶液并回收NaHSO4。其中装置正确且能达到相应实验目的是
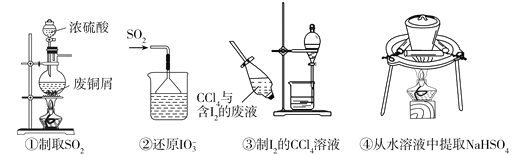
A. ①②③④ B. ①②③ C. ②③④ D. ②④
难度: 中等查看答案及解析
-
青出于蓝而胜于蓝,“青”指的是靛蓝,是人类使用历史悠久的染料之一,下列为传统制备靛蓝的过程:
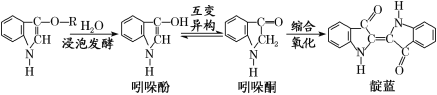
下列说法不正确的是
A. 靛蓝的分子式为C16H10N2O2
B. 浸泡发酵过程发生的反应为取代反应
C. 吲哚酚的苯环上的二氯代物有4种
D. 1mol吲哚酚与H2加成时可消耗4mol H2
难度: 中等查看答案及解析
-
主族元素W、X、Y、Z的原子序数依次增加,且均不大于20,它们可以组成化学式为ZXY3W8的硅酸盐。X3+与W2-具有相同的电子层结构,W、Z与X、Y的质子数之和相等。下列判断正确的是
A. 化合物ZXW2的水溶液呈碱性
B. 简单气态氢化物稳定性:Y>W
C. 最高价氧化物对应水化物酸性:X>Y
D. 简单离子半径:X>Z
难度: 中等查看答案及解析
-
锂亚硫酰氯(Li/SOCl2)电池是实际应用电池系列中比能量最高的一种电池,剖视图如图所示,一种非水的LiAlCl4的SOCl2溶液为电解液。亚硫酸氯既是电解质,又是正极活性物质,其中碳电极区的电极反应式为2SOCl2+4e−=4Cl−+S+SO2↑,该电池工作时,下列说法错误的是
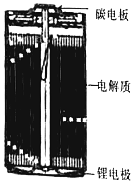
A. 锂电极区发生的电极反应:Li-e−=Li+
B. 放电时发生的总反应:4Li+2SOCl2=4LiCl+SO2↑+S
C. 锂电极上的电势比碳电极上的低
D. 若采用水溶液代替SOCl2溶液,电池总反应和效率均不变
难度: 中等查看答案及解析
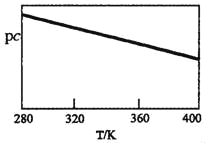
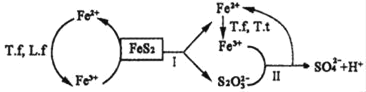
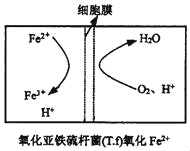
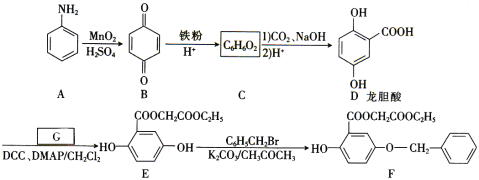
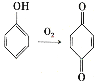 。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(
。参照上述合成路线,设计一条以苯酚、乙醇为原料制备龙胆酸乙酯(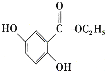 )的合成路线(无机试剂任用)。_________
)的合成路线(无机试剂任用)。_________