-
燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)=2Fe2O3(s)+8SO2(g) ΔH=﹣3412.0kJ·mol−1
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=﹣25.0kJ·mol−1
2C(s)+O2(g)=2CO(g) ΔH=﹣221.0 kJ·mol−1
则2FeS2(s)+7O2(g)+3C(s)=2Fe(s)+3CO2(g)+4SO2(g) ΔH=____kJ·mol−1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2-+4OH−⇌2SO42-+C1−+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
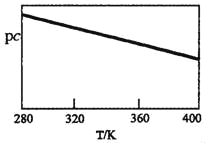
由图分析可知,该脱硫反应是____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
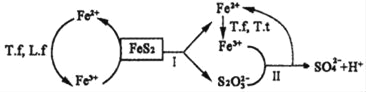
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
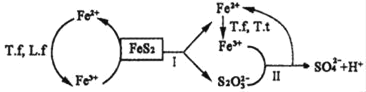
已知:脱硫总反应为:FeS2+14Fe3++8H2O=2SO42-+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O=S2O32-+7Fe2++6H+;
写出Ⅱ反应的化学方程式____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:
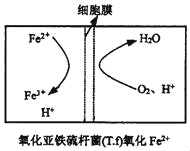
该细胞膜为____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为______。该方法在高温下脱硫效率大大降低,原因是_________。
-
燃煤及工业废气中的SO2是形成酸雨的主要原因,消除SO2是减少酸雨形成的有效方法。完成下列问题:
(1)已知:4FeS2(s)+11O2(g)═2Fe2O3(s)+8SO2(g)△H=﹣3412.0kJ•mol﹣1
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣25.0 kJ•mol﹣1
2C(s)+O2(g)═2CO(g)△H=﹣221.0 kJ•mol﹣1
则2FeS2(s)+7O2(g)+3C(s)═2Fe(s)+3CO2(g)+4SO2(g)△H=_____kJ•mol﹣1。
(2)碱性NaClO2溶液脱硫法
SO2与碱性NaClO2溶液反应的离子方程式为2SO2+ClO2﹣+4OH﹣⇌2SO42﹣+C1﹣+2H2O,已知pc=﹣lgc(SO2)。在刚性容器中,将含SO2的废气通入碱性NaClO2溶液中,测得pc与温度的关系如图所示。
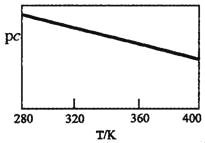
由图分析可知,该脱硫反应是_____反应(填“放热”或“吸热”);若温度不变,增大压强,该脱硫反应的平衡常数K_____(填“增大”、“减小”或“不变”)。
(3)燃料细菌脱硫法
①含FeS2的燃煤可用氧化亚铁硫杆菌(T.f)、氧化亚铁微螺菌(L.f)、氧化硫硫杆菌(T.t)进行脱硫,其脱硫过程如图所示:
已知:脱硫总反应为:FeS2+14Fe3++8H2O═2SO42﹣+15Fe2++16H+,
Ⅰ反应的化学方程式为:FeS2+6Fe3++3H2O═S2O32﹣+7Fe2++6H+;
写出Ⅱ反应的化学方程式_____。
②在上述脱硫反应中,氧化亚铁硫杆菌(T.f)与Fe3+的形成过程可视为下图所示的原电池:
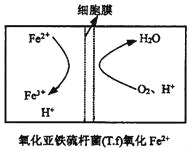
该细胞膜为_____(填“阳离子交换膜”或“阴离子交换膜”)。该电池的正极电极反应式为_____。该方法在高温下脱硫效率大大降低,原因是_____。
-
煤在燃烧时会产生SO2,造成环境污染。下列说法正确的有
A.SO2是形成酸雨的主要气体
B.用碱液吸收燃煤废气可减少环境污染
C.往燃煤中混入生石灰,可减少SO2排放
D.用水溶解、过滤除去煤中的单质硫以减少SO2排放
-
大气污染物主要成分是SO2、NO2、CxHy及可吸入颗粒等,主要来自于燃煤、机动车尾气和工业废气。
(1)上述成分中能形成酸雨的是________(填化学式)。
(2)煤的气化是高效、清洁利用煤炭的重要途径之一。利用煤的气化获得的水煤气(主要成分为CO、CO2和H2)在催化剂作用下可以合成绿色燃料甲醇。
已知:CO2(g) + 3H2(g) =CH3OH(g) + H2O(g) ΔH 1 = − 58.7 kJ·mol-1
CO2(g) + H2(g) =CO(g) + H2O(g) ΔH 2 = + 41.0 kJ·mol-1
CO 与 H2 生成 CH3OH 气体反应的热化学方程式是___________。
(3)空气质子交换法治理SO2,其原理是将含有SO2的烟气与O2通过电化学反应制得硫酸,负极的电极反应式是___________。
(4)湿法吸收工业尾气中的NO2,常选用纯碱溶液,将NO2转化为两种氮元素的常见含氧酸盐。反应的离子方程式是___________。
(5)用高能电子束激活烟气(主要成分是SO2、NO2、H2O等),会产生O3等强氧化性微粒。烟气经下列过程可获得化肥。
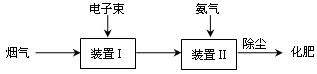
该化肥中含有的离子是______________(填离子符号)。
-
下列有关环境保护的说法中错误的是( )
A.燃煤时加入适量石灰石,可减少废气中的SO2
B.臭氧的体积分数超过10-10%的空气有利于人体的健康
C.各国工业大量排放二氧化碳是全球气候变暖的主要原因
D.废旧电池中的汞、锅、铅等重金属盐对土壤和水源会造成污染
-
下列关于环境问题的说法正确的是
A.燃煤时加入适量石灰石,可减少废气中的SO2
B.臭氧的体积分数超过10-14%的空气有利于人体的健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.SO2、NO2或CO2都会导致酸雨的形成
-
下列有关环境问题的说法正确的是 ( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
-
下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
-
下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染
-
下列有关环境问题的说法正确的是( )
A.燃煤时加入适量石灰石,可减少废气中SO2的含量
B.臭氧的体积分数超过10-4%的空气有利于人体健康
C.pH在5.6~7.0之间的降水通常称为酸雨
D.含磷合成洗涤剂易于被细菌分解,故不会导致水体污染






