-
2019年3月召开的“两会”指出,当前我国城乡居民正在进入生活质量全面提升时期,人们对生态环境质量非常关注,迫切希望生态环境越来越好。下列做法有利于环境保护的是( )
A. 市区禁止自行车通行
B. 自己尽量不做饭,多叫外卖
C. 提倡将生活垃圾进行分类处理
D. 将工业废水注入地下岩石层,减少排放量
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 2.3g钠在足量的氧气中燃烧,转移的电子数为0.1NA
B. 标准状况下,2.24L Cl2溶于水或NaOH溶液中转移的电子数均为0.1NA
C. 常温常压下,18gH2O含有的氢原子总数为NA
D. 0.1molCH3OH中所含C-H键的数目为0.4NA
难度: 中等查看答案及解析
-
下列关于有机化合物的说法正确的是
A. 用酸性高锰酸钾溶液可以鉴别苯和甲烷
B. 苯酚、苯乙醇和苯乙酸都可以与钠反应生成氢气
C. 纤维素、蛋白质、葡萄糖在一定条件下都可发生水解反应
D. 甲醇与二甲醚互为同分异构体
难度: 简单查看答案及解析
-
根据下列实验操作和现象得出的结论错误的是
选项
实验操作
现象
结论
A
向碘水中加入等体积CCl4,振荡后静置
上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
B
常温下,将浓盐酸、二氧化锰放入烧瓶中,用淀粉碘化钾试液检验
试液不变蓝
常温下,浓盐酸、二氧化锰没有发生化学反应
C
向NaCl、NaI的混合稀溶液中滴入几滴稀AgNO3溶液
有黄色沉淀生成
Ksp(AgCl)>Ksp(AgI)
D
向20%蔗糖溶液中加入少量稀H2SO4,加热;再加入少量银氨溶液;
未出现银镜
蔗糖未水解
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期元素X、Y、Z、M的原子序数依次增大,已知元素X的一种高硬度单质是宝石,Y2+电子层结构与氖相同,Z的质子数为偶数,室温下M单质为淡黄色固体。下列叙述错误的是
A. 简单氢化物稳定性:X>Z
B. Z元素的最高价氧化物是制造光导纤维的主要原料
C. 化合物XM2中含有极性共价键和非极性共价键
D. 简单离子半径:Y<M
难度: 中等查看答案及解析
-
用间接电化学法可对大气污染物NO进行无害化处理,其工作原理如图所示。下列说法正确的是
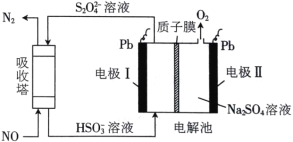
A. 电极I为阴极,电极反应式为2H2O+2e一=2OH-+H2↑
B. 电解时H+由电极I向电极II迁移
C. 吸收塔中的反应为2NO+2S2O42-+2H2O=N2+4HSO3-
D. 每处理1 mol NO,可同时得到32gO2
难度: 中等查看答案及解析
-
室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。已知:Ksp(NaUr)=4.9×10-5,Ka(HUr)=2.0×10-6。下列说法正确的是

A. 上层清液中,c(Ur-) = 7.0×10-2mol·L-1
B. 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小
C. 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)
D. 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)
难度: 困难查看答案及解析
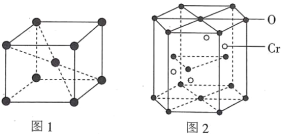
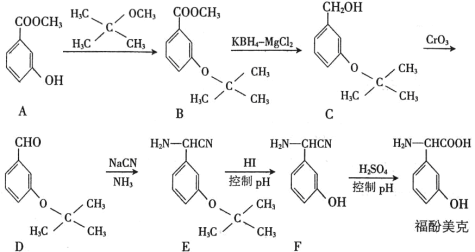
 的合成路线:__________。
的合成路线:__________。