-
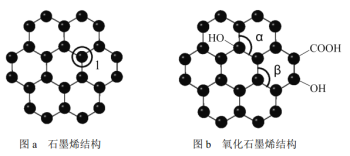
下列具有特殊性能的材料中,由主族元素和副族元素形成的化合物是
A. 半导体材料砷化镓 B. 透明陶瓷材料硒化锌
C. 吸氢材料镧镍合金 D. 超导材K3C60
难度: 简单查看答案及解析
-
下列说法正确是
A. 同一能层同一能级的不同原子轨道能量相等
B. 稀有气体元素原子最外层电子排布处于全满状态,所以稀有气体稳定
C. 元素原子的最外层电子即为该元素的价电子
D. 电子云描述的是电子在核外空间的运动轨迹
难度: 简单查看答案及解析
-
下列表达方式正确的是
A. As的电子排布式:[Ar]4s24p3
B. N的价电子排布图
C. Cr原子结构示意图

D. Fe2+的价电子排布式为:[Ar]3d54s1
难度: 简单查看答案及解析
-
下列分子中的中心原子杂化轨道的类型相同的是
A. CO2与SO2 B. CH4与NH3 C. BeCl2与BF3 D. C2H4与C2H2
难度: 中等查看答案及解析
-
下列分子中,既有σ键,又有π键的是:①CH4;②CO2;③N2;④H2O2;⑤C2H4;⑥HClO
A. ①②③④⑤⑥ B. ②③④⑤⑥ C. ②③④⑤ D. ②③⑤
难度: 简单查看答案及解析
-
下列物质中不含配位键的是
A. H3O+ B. Ag(NH3)2+ C. AlF63- D. SO2
难度: 简单查看答案及解析
-
下列关于元素周期表和元素周期律说法正确的是
A. 主族元素最后一个电子都填在p能级上,价电子通式为ns2np1-5
B. Ag的价电子为4d105s1 ,由此可判断Ag在第五周期ⅠB族,处于d区
C. 过渡元素只包含副族元素的金属
D. 元素性质随核电荷数递增发生周期性的递变是因为元素的原子核外电子的排布发生周期性的变化
难度: 简单查看答案及解析
-
下列有关微粒性质的排列顺序中,错误的是
A. 元素的电负性:P<O<F
B. 元素的第一电离能:C<N<O
C. 离子半径:O2->Na+>Mg2+
D. 原子的未成对电子数:Mn>Si>Cl
难度: 简单查看答案及解析
-
A、B、C、D的价电子排布式均为ns2np5,且原子序数依次增大,以下说法正确的是
A. 四种元素是卤族元素,最高化合价均为+7
B. 气态氢化物的稳定性顺序为:HA>HB>HC>HD
C. 酸性大小顺序为:HA>HB>HC>HD
D. A、B、C、D四种元素均为其所在周期第一电离能最大的元素
难度: 简单查看答案及解析
-
水星大气中含有一种被称为硫化羰(化学式为COS)的物质。已知硫化羰与CO2的结构相似,但能在O2中完全燃烧,下列有关硫化羰的说法正确的是
A. OCS的电子式为
B. OCS分子中三个原子位于同一直线上
C. OCS的沸点比CO2的低
D. OCS分子中含有1个σ键和1个π键
难度: 简单查看答案及解析
-
能够用键能解释的是
A. 氮气的化学性质比氧气稳定 B. 常温常压下,溴呈液体,碘为固体
C. 稀有气体一般很难发生化学反应 D. 硝酸易挥发,硫酸难挥发
难度: 简单查看答案及解析
-
下列分子含有非极性键的极性分子的是
A.
B. C60 C. HCN D. CH3CH2Cl
难度: 简单查看答案及解析
-
60年代美国化学家鲍林提出了一个经验规则:设含氧酸的化学式为HnROm,其中(m-n)为非羟基(-OH)氧原子数,鲍林认为含氧酸的强弱与非羟基氧原子数(m-n)的关系见下表
m-n
0
1
2
3
含氧酸强度
弱酸
中强
强
很强
实例
HClO
H3PO4
HNO3
HClO4
由此判断下列含氧酸酸性最强的是
A. H3AsO4 B. H2CrO4 C. HMnO4 D. H2SeO4
难度: 简单查看答案及解析
-
下列物质的分子中,键角最小的是
A. H2O B. BF3 C. H2S D. CH4
难度: 简单查看答案及解析
-
激发态原子和基态原子可以通过电子跃迁的方式相互转换,跃迁过程中可得到光谱,下列说法正确的是
A. 元素K的焰色反应呈紫红色,其中紫色对应的辐射波长约为700nm
B. 以下实验装置测得的是氢元素的吸收光谱
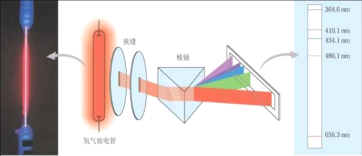
C.
该电子排布图表示的是基态氧原子的电子排布图
D. 原子光谱可以用于定性鉴定元素
难度: 简单查看答案及解析
-
X、Y、Z、Q、T均为前四周期元素,X原子的M层上有两个未成对电子且无空轨道;Y的其中一种离子可通过硫氰化钾溶液鉴别;基态Z原子的L电子层的p亚层上有一个空轨道;基态Q原子的L电子层的p亚层上有一对成对电子;T原子的M电子层上p轨道半充满。下列叙述正确的是( )
A. 元素Y和Q形成化合物Y2Q3可溶于水
B. T有一种单质的空间构型为正四面体
C. X和Q结合生成的化合物为离子化合物
D. Z的氢化物Z2H4结构中没有双键
难度: 中等查看答案及解析
-
下列离子的 VSEPR 模型与离子的空间立体构型一致的是
A. ClO3- B. NO2- C. ClO4- D. SO32-
难度: 简单查看答案及解析
-
关于氢键,下列说法正确的是
A. 分子中有N、O、F原子,分子间就存在氢键
B. 因为氢键的缘故,
比
熔沸点高
C. 由于氢键比范德华力强,所以H2O分子比H2S分子稳定
D. “可燃冰”——甲烷水合物(例如:8CH4·46H2O)中CH4与H2O之间存在氢键
难度: 简单查看答案及解析
-
肼(N2H4)分子中所有原子均达到稀有气体原子的稳定结构,它的沸点高达113℃,已知肼的球棍模型如图所示,下列有关说法不正确的是
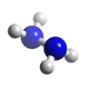
A. 肼是由极性键和非极性键构成的非极性分子
B. 肼沸点高达113℃,可推测肼分子间能形成氢键
C. 肼分子中N原子采用sp2杂化方式
D. 32g肼分子中含有5NA个σ键
难度: 简单查看答案及解析
-
已知硼元素的电负性比氯元素的小,三氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述不正确的是
A. 三氯化硼溶于水能导电
B. 三氯化硼加到水中使溶液的pH升高
C. 三氯化硼分子呈正三角形,属非极性分子
D. 三氯化硼遇水蒸气会产生白雾
难度: 简单查看答案及解析