-
下列反应属于氧化还原反应且焓变大于0的是
A. 灼热的炭与水蒸气反应 B. Zn和稀H2SO4反应制氢气
C. Ba(OH)2·8H2O和NH4Cl反应 D. HCl溶液和NaOH溶液反应
难度: 简单查看答案及解析
-
下列电离方程式正确的是
A. H2CO3
2H++CO32- B. NaHSO4
Na++ HSO4-
C. NaHS
Na++H++S2− D. H2O+H2O
H3O++OH−
难度: 简单查看答案及解析
-
下列说法正确的是
A. 氯水能导电,所以氯气是电解质
B. 碳酸钙不溶于水,所以它是非电解质
C. 固体磷酸是电解质,所以磷酸在熔化状态下和溶于水时都能导电
D. 胆矾虽不能导电,但它属于电解质
难度: 中等查看答案及解析
-
常温下,由水电离出的c(H+)=10-13 mol·L-1的溶液中,下列离子组一定能大量共存的是
A. NH4+、Al3+、NO3-、Cl-
B. Na+、K+、Cl-、NO3-
C. Cu2+、Fe2+、Cl-、 NO3-
D. Na+、AlO2-、SO42-、SiO32-
难度: 中等查看答案及解析
-
在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是
A. 0.02 mol·(L·s)-1 B. 1.8 mol·(L·s)-1
C. 1.2 mol·(L·s)-1 D. 0.18 mol·(L·s)-1
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大
④保持压强不变,充入N2使容器体积增大
A. ①② B. ①③ C. ②③ D. ③④
难度: 中等查看答案及解析
-
在含有酚酞的0.1 mol·L-1的氨水中加入少量的NH4Cl晶体,则溶液颜色
A. 变蓝色 B. 变深 C. 变浅 D. 不变
难度: 简单查看答案及解析
-
已知室温下0.01 mol·L-1 CH3COOH溶液中c(H+)=4.32×10-4 mol·L-1,则该CH3COOH溶液中水的离子积常数
A. <1×10-14 B. >1×10-14
C. =1×10-14 D. 无法确定
难度: 简单查看答案及解析
-
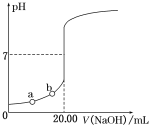
下列与滴定实验有关的说法中正确的是
A. 用NaOH滴定盐酸时,只能用酚酞作指示剂
B. 用KMnO4滴定亚硫酸钠溶液的实验中不需要另外加入指示剂
C. 用滴定管准确量取20.0 mL盐酸
D. 用NaOH滴定盐酸时,若滴定结束时俯视刻度,会导致测定结果偏高
难度: 中等查看答案及解析
-
对于可逆反应:mA(g)+nB(g)
pC(g)+qD(g) ΔH=?,反应物A的转化率随时间和温度的变化如下图所示,下列判断正确的是
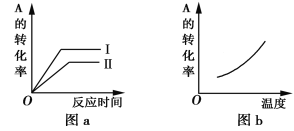
A. 由图b可知,ΔH<0
B. 图a中要使平衡状态Ⅱ到平衡状态Ⅰ,可以加入催化剂
C. 若m+n>p+q,则由状态Ⅱ到状态Ⅰ可以压缩容器体积
D. 在不同的平衡状态Ⅰ和Ⅱ时,化学平衡常数一定相同
难度: 中等查看答案及解析
-
下列说法正确的是
A. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃的条件下ΔH不同
B. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
C. 某反应低温条件下能够自发进行,则高温条件下一定能够自发
D. KNO3溶于水的过程熵值减小
难度: 简单查看答案及解析
-
在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得达到平衡时的有关数据如下[已知X(g)+3Y(g)
2Z(g) ΔH=−Q kJ·mol−1]:
容器
甲
乙
丙
反应物投入量
1 mol X、3 mol Y
2 mol Z
4 mol Z
Z的浓度(mol·L−1)
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
体系压强(Pa)
p1
p2
p3
反应物转化率
α1
α2
α3
下列说法正确的是
A. 2c1>c3 B. a+b=Q C. 2p2<p3 D. α1+α3>1
难度: 中等查看答案及解析