-
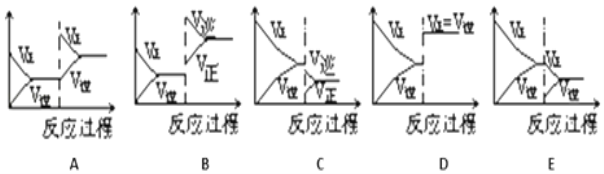
已知化学反应A2(g)+B2(g)=2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
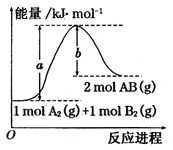
A. 每生成2分子AB吸收bkJ热量
B. 断裂1molA-A和1molB-B键,放出akJ能量
C. 该反应中反应物的总能量高于生成物的总能量
D. 该反应热△H=+(a-b)kJ/mol
难度: 中等查看答案及解析
-
已知:键能数据如下:
H-H
Cl-Cl
H-Cl
键能(kJ/mol)
436
243
a
下列有关H2(g)与Cl2(g)反应生成HCl(g)的说法正确的是( )
A. H2(g)与Cl2(g)反应的热化学方程式:H2(g)与Cl2(g)=2HCl(g) △H=(2a-679)kJ/mol
B. H2(g)与Cl2(g)反应一定是放热反应
C. 若a=431,则反应生成2molHCl时的△H=183kJ/mol
D. 反应物的总能量小于生成物的总能量
难度: 中等查看答案及解析
-
根据反应Br+H2
HBr+H的能量随反应历程的变化示意图甲进行判断,下列叙述中不正确的是( )
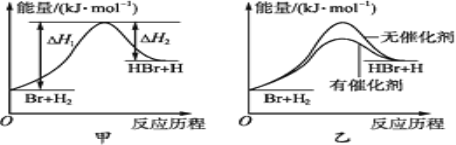
A. 正反应吸热
B. 加入催化剂,该化学反应的反应热不变
C. 加入催化剂后,该反应的能量随反应历程的变化示意图可用图乙表示
D. 加入催化剂可增大正反应速率,降低逆反应速率
难度: 中等查看答案及解析
-
下列依据热化学方程式得出的结论正确的是( )
A. 已知P(白磷,s)=P(红磷,s)△H<0,则白磷比红磷稳定
B. 已知2H2(g)+O2(g)=2H2O(g)△H= -483.6kJ•mol-1,则氢气的标准燃烧热为241.8kJ•mol-1
C. 已知2C(s)+2O2(g)=2CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g)△H=b kJ•mol-1,则a>b
D. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=-57.3kJ•mol-1,则含40.0gNaOH的稀溶液与浓硫酸完全中和,放出大于57.3kJ的热量
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 所有反应的活化能不可能接近零
B. 弱电解质的导电性不一定比强电解质的导电性弱
C. 燃烧热是指1 mol任何物质完全燃烧生成稳定氧化物所放出的热量
D. H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1表示强酸溶液与强碱溶液反应的中和热
难度: 简单查看答案及解析
-
下列热化学方程式中,△H能正确表示物质的燃烧热的是( )
A. CO(g)+1/2O2(g)=CO2(g);△H=-283.0kJ/mol
B. C(s)+1/2O2(g)=CO(g);△H=-110.5kJ/mol
C. H2(g)+1/2O2(g)=H2O(g);△H=-241.8kJ/mol
D. 2C8H18(l)+25O2(g)=16CO2(g)+18H2O(l);△H=-11036kJ/mol
难度: 中等查看答案及解析
-
C2H5OH、CH4、C3H8、C是常用的燃料,它们的燃烧热依次为1366.8kJ·mol-1、890.3kJ·mol-1、2219.9kJ·mol-1、393.5kJ·mol-1。相同质量的这四种燃料,完全燃烧时放出热量最少的( )
A. C2H5OH B. CH4 C. C3H8 D. C
难度: 简单查看答案及解析
-
下列说法错误的是( )
A. S(g)+O2(g)=SO2(g)△H1 S(s)+O2(g)=SO2(g)△H2,则△H1<△H2
B. Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) △H=-261kJ·mol-1,则反应总能量>生成物总能量
C. 已知C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定
D. 相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子所具有的能量为E2,则2E1=E2
难度: 中等查看答案及解析
-
分别向1L 0.5mol•L﹣1的Ba(OH)2溶液中加入①浓硫酸、②稀硫酸、③稀硝酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是( )
A. △H1>△H2>△H3 B. △H1<△H2<△H3
C. △H1>△H2=△H3 D. △H1=△H2<△H3
难度: 中等查看答案及解析
-
在一定温度下的定容密闭容器中,当下列物理量不再变化时,表明反应:A(s)+2B(g)
C(g)+D(g)已达平衡的是( )
A. 混合气体的压强 B. 混合气体密度
C. A的物质的量浓度保持不变 D. 气体总物质的量保持不变
难度: 中等查看答案及解析
-
在1L密闭容器中,把1molA和1mol B混合发生如下反应:3A(g)+B(g)
xC(g)+2D(g),当反应达到平衡时,生成0.4molD,并测得C的平衡浓度为0.4 mol/L,下列叙述中不正确的是( )
A. x的值为2 B. A的转化率为60%
C. B的平衡浓度为0.8mol/L D. D的体积分数为25%
难度: 困难查看答案及解析
-
可逆反应A(g)+ 4B(g)
C(g)+ D(g),在四种不同情况下的反应速率如下,其中表示反应进行得最快的是( )
A. vA=0.15mol/(L·min) B. vB=0.6 mol/(L·min)
C. vC=0.4 mol/(L·min) D. vD=0.005 mol/(L·s)
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理(平衡移动原理)解释的是( )
①铁在潮湿的空气中容易生锈②二氧化氮与四氧化氮的平衡体系,加压缩小体积后颜色加深③实验室可用排饱和食盐水的方法收集氯气④钠与氯化钾共融制备钾Na(l)+KCl(l)
K(g)+NaCl(l)⑤开启啤酒瓶后,瓶中马上泛起大量泡沫
A. ③④ B. ①② C. ①⑤ D. ①②⑤
难度: 中等查看答案及解析
-
将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1③2s时物质A的转化率为70%④2s时物质B的浓度为0.7 mol·L-1,其中正确的是( )
A. ①③ B. ①④ C. ②③ D. ③④
难度: 中等查看答案及解析
-
反应X(g)+Y(g)
2Z(g) ΔH<0,达到平衡时,下列说法正确的是( )
A. 减小容器体积,平衡向右移动
B. 加入催化剂,Z的产率增大
C. 增大c(X),X的转化率增大
D. 降低温度,Y的转化率增大
难度: 简单查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线规律的是
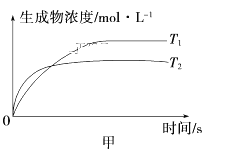
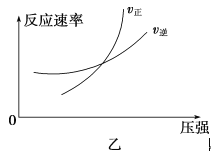
A. a+b>c+d T1>T2 ΔH>0
B. a+b>c+d T1<T2 ΔH<0
C. a+b<c+d T1>T2 ΔH>0
D. a+b<c+d T1<T2 ΔH<0
难度: 困难查看答案及解析
-
0.10mol/LCH3COOH溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆向移动
B. 加入少量NaOH固体,平衡向正向移动
C. 加入少量0.10mol/LHCl溶液,溶液中C(H+)减少
D. 加入少量CH3COONa固体,平衡向正向移动
难度: 中等查看答案及解析
-
常温下,关于溶液的稀释,下列说法正确的是( )
A. pH=3的醋酸溶液稀释100倍,pH=5
B. pH=4的H2SO4溶液加水稀释100倍,溶液中由水电离产生的c(H+)=1×10-6 mol·L-1
C. 将1 L 0.1 mol·L-1的Ba(OH)2溶液稀释为2L,pH=13
D. pH=8的NaOH溶液稀释100倍,其pH=6
难度: 中等查看答案及解析
-
25℃时,水的电离达到平衡:H2O⇌H++OH- △H>0,下列叙述正确的是( )
A. 向平衡体系中加入水,平衡正向移动,c(H+)增大
B. 将水加热,Kw增大,pH不变
C. 向水中加入少量硫酸氢钠固体,
增大
D. 向水中加入少量NaOH固体,平衡正向移动,c(H+)降低
难度: 困难查看答案及解析