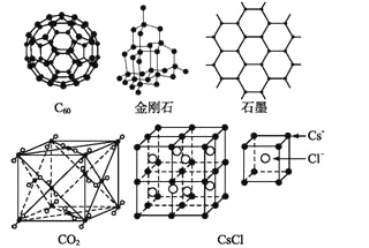
-
12C和13C原子之间,相等的是
A. 原子质量 B. 中子数 C. 质量数 D. 电子数
难度: 简单查看答案及解析
-
区分晶体和非晶体最可靠的科学方法是( )
A. 观察外观是否规则
B. 测定是否有固定的熔点
C. 验证是否有各向异性
D. 进行X射线衍射实验
难度: 中等查看答案及解析
-
已知含氧酸可用通式XOm(OH)n来表示,如X是S,则m=2,n=2,则这个式子就表示H2SO4。一般而言,该式中m大的是强酸,m小的是弱酸。下列各含氧酸中酸性最强的是( )
A. H2SeO3 B. HMnO4 C. H3BO3 D. H3PO4
难度: 中等查看答案及解析
-
下列基态原子的外围价电子排布式中,正确的是( )
A. 3d54s1 B. 3d44s2 C. 3d94s2 D. 3d13p6
难度: 简单查看答案及解析
-
电子由3d能级跃迁至4p能级时,可通过光谱仪直接摄取( )
A. 电子的运动轨迹图象 B. 原子的吸收光谱
C. 电子体积大小的图象 D. 原子的发射光谱
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 同一原子中,1s、2s、3s能级最多容纳的电子数不相同
B. 能层为1时,有自旋方向相反的两个轨道
C. “量子化”就是连续的意思,微观粒子运动均有此特点
D. s电子云是球形对称的,其疏密程度表示电子在该处出现的几率大小
难度: 简单查看答案及解析
-
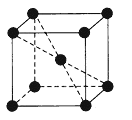
以下列出的是一些基态原子的2p轨道和3d轨道中电子排布的情况,违反洪特规则的有( )
A. ①②③ B. ④⑤⑥ C. ②④⑥ D. ③④⑥
难度: 简单查看答案及解析
-
现有三种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A. 第一电离能:③>②>① B. 原子半径:③>②>①
C. 电负性:③>②>① D. 最高正化合价:③>②>①
难度: 简单查看答案及解析
-
下图是第三周期11
17号元素某些性质变化趋势的柱形,下列有关说法中正确的是( )
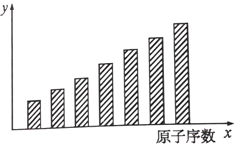
A. y轴表示的可能是电离能 B. y轴表示的可能是电负性
C. y轴表示的可能是原子半径 D. y轴表示的可能是形成基态离子转移的电子数
难度: 简单查看答案及解析
-
研究表明:H2O2具有立体结构,两个氢原子像在一本半展开的书的两页纸上,两页纸面的夹角为94°,氧原子在书的夹缝上,O—H键与O—O键之间的夹角为97°。下列说法不正确的是( )
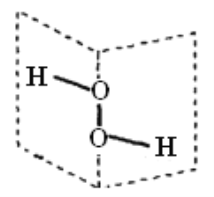
A. H2O2分子中既含极性键,又含非极性键
B. H2O2为极性分子
C. H2O2分子中的两个O原子均是sp3杂化
D. H2O2分子中既有σ键,又有π键
难度: 中等查看答案及解析
-
下列大小比较不正确的是( )
A. 熔沸点:S<NaCl<SiO2
B. 酸性:HNO2<HNO3;H3PO4<H2SO4
C. 键角:H2O中H﹣O﹣H<NH3中H﹣N﹣H<CH4中H﹣C﹣H
D. 键长:C﹣H<O﹣H
难度: 中等查看答案及解析
-
下列粒子属等电子体的是( )
A. NO和O2 B. CH4和NH4+ C. NH2ˉ 和H2O2 D. HCl和H2O
难度: 中等查看答案及解析
-
下列各组微粒的空间构型相同的是( )
①NH3和H2O ②NH4+和H3O+ ③NH3和H3O+④O3和SO2 ⑤CO2和BeCl2⑥SiO44-和SO42-⑦BF3和Al2Cl6
A. 全部 B. 除④⑥⑦以外 C. ③④⑤⑥ D. ②⑤⑥
难度: 中等查看答案及解析
-
下列微粒中,含有孤电子对的是( )
A. SiH4 B. H2O C. CH4 D. NH4+
难度: 简单查看答案及解析
-
下列分子中中心原子的杂化方式和分子的空间构型均正确的是( )
A. C2H2:sp2、直线形
B. SO42-:sp3、三角锥形
C. H3O+:sp3、V形
D. BF3:sp2、平面三角形
难度: 中等查看答案及解析
-
下列配合物的水溶液中加入硝酸银不能生成沉淀的是
A. [Co(NH3)4Cl2] Cl
B. [Co(NH3)3Cl3]
C. [Co(NH3)6] Cl3
D. [Cu(NH3)4]Cl2
难度: 中等查看答案及解析
-
下列化合物中,既含有离子键,又含有非极性共价键的是 ( )
A. CaO B. SiO2 C. NH4Cl D. Na2O2
难度: 简单查看答案及解析
-
关于氢键,下列说法正确的是( )
A. 氢键是一种化学键
B. 冰中存在氢键、液态氟化氢中不存在氢键
C. H2O是一种非常稳定的化合物,这是由于氢键所致
D. 氨气极易溶于水,重要的原因之一是由于氨分子与水分子之间能形成氢键
难度: 中等查看答案及解析
-
下列物质性质的变化规律与分子间作用力有关的是( )
A. F2,Cl2,Br2,I2的沸点依次升高
B. 金刚石的硬度大于硅,其熔、沸点也高于硅
C. NaF,NaCl,NaBr,NaI的熔点依次降低
D. HF,HCl,HBr,HI的热稳定性依次减弱
难度: 简单查看答案及解析
-
下列化合物中含有手性碳原子的是( )
A. CCl2F2 B. CH3﹣CHCl﹣COOH C. CH3CH2OH D. CH2Cl﹣OH
难度: 中等查看答案及解析
-
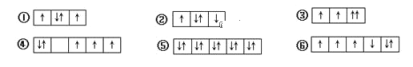
关于下图不正确的说法是
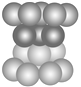
A. 此种最密堆积为面心立方最密堆积
B. 该种堆积方式称为铜型
C. 该种堆积方式可用符号……ABCABC……表示
D. 该种堆积方式称为镁型
难度: 中等查看答案及解析
-
根据表中给出物质的熔点数据(AlCl3沸点为260 ℃),判断下列说法错误的是( )
晶体
NaCl
MgO
SiCl4
AlCl3
晶体硼
熔点/℃
801
2 800
-70
180
2 500
A. MgO中的离子键比NaCl中的离子键强
B. SiCl4晶体是分子晶体
C. AlCl3晶体是离子晶体
D. 晶体硼是原子晶体
难度: 简单查看答案及解析
-
某晶体中含有A、B、C三种元素,其排列方式如图所示,晶体中A、B、C的原子个数之比依次为( )
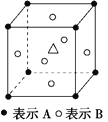
A. 1∶3∶1 B. 2∶3∶1
C. 8∶6∶1 D. 4∶3∶1
难度: 简单查看答案及解析