-
常温下,已知:CH4(g)+2O2(g)=CO2(g)+2H2O(1) ∆H=-980kJ/mol
2H2(g)+O2(g)=2H2O(1) △H=-560kJ/mol
现有CH4和H2组成的混合气体共0.4mol,使其在O2中完全燃烧,恢复至常温共放出252kJ的热量,则CH4与H2的物质的量之比是
A. 1:1 B. 1:2 C. 2:3 D. 3:2
难度: 简单查看答案及解析
-
某温度下,有pH相同的H2SO4溶液和Al2(SO4)3溶液,在H2SO4溶液中由水电离出的H+浓度为10-a mol·L-1,在Al2(SO4)3溶液中由水电离的H+浓度为10-bmol·L-1,则此温度下的Kw为
A. 1×10-14 B. 1×10-2a C. 1×10-(7+a) D. 1×10-(a+b)
难度: 简单查看答案及解析
-
平衡有多种类型,如化学平衡、溶解平衡、电离平衡。下列不存在平衡的是(不考虑水的电离平衡)
A. 稀醋酸水溶液中
B. 氢氧化钙悬浊液中
C. 二氧化硫与氧气反应的混合物中
D. 稀氯化钠水溶液中
难度: 中等查看答案及解析
-
已知相同条件下,HClO的电离常数小于H2CO3的第一级电离常数。为了提高氯水中HClO的浓度,可加入
A. HCl B. CaCO3(s) C. H2O D. NaOH(s)
难度: 中等查看答案及解析
-
下列三个数据:①7.2×10-4、②2.6×10-4、③4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可以发生如下反应:NaCN+HNO2=HCN+NaNO2;NaCN+HF=HCN+NaF ; NaNO2+HF=HNO2+NaF , 由此可判断下列叙述中正确的是
A. HNO2的电离平衡常数是③ B. HNO2的电离平衡常数是①
C. HCN的电离平衡常数是② D. HF的电离平衡常数是①
难度: 中等查看答案及解析
-
室温时,下列比值为2∶1的是
A. pH=2 与pH=1的硝酸中c(H+)之比
B. Na2CO3溶液中c(Na+)与c(CO32-)之比
C. 0.2mol/L 与0 lmol/L 醋酸中c(H+)之比
D. pH=7的硫酸铵与氨水混合溶液中c(NH4+)与c(SO42-)之比
难度: 中等查看答案及解析
-
下列各变化中属于原电池反应的是
A. 空气中铝表面迅速形成保护层
B. 镀锌铁表面锌有划损时,也能阻止铁被氧化
C. 红热的铁丝与冷水接触,表面形成蓝黑色保护层
D. 锌和稀硫酸反应时,用锌粉比等质量的锌粒可使反应加快
难度: 简单查看答案及解析
-
在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度
增大
D. 加入MgCl2固体,HS-浓度减小
难度: 简单查看答案及解析
-
已知:N2O4(g)
2NO2(g) ,将装有N2O4和NO2混合气体的烧瓶浸入热水中,烧瓶内混合气体的颜色逐渐变深。下列结论不能说明该反应已经达到化学平衡状态的是
A. 烧瓶内气体的质量不再变化
B. 烧瓶内气体的颜色不再变化
C. 烧瓶内气体的压强不再变化
D. N2O4的消耗速率与NO2的消耗速率之比为1:2
难度: 简单查看答案及解析
-
室温下,下列各组离子在指定溶液中可能大量共存的是
A. 饱和氯水中Cl-、Na+、SO32-、NO3-
B. 水电离的氢离子浓度为1.0×10-13mol/L 溶液中:CO32-、K+、SO42-、Br-
C. pH=12的溶液中NO3-、 I-、Na+、Al3+
D. Na2S溶液中SO42-、K+、Cl-、Cu2+
难度: 简单查看答案及解析
-
下列说法正确的是
A. 化学平衡正向发生移动时,平衡常数K值一定增大
B. HS-的电离方程式:HS-+H2O
S2-+H3O+
C. 由水电离出的c(H+)=1×10-13mol/L的溶液中,可能大量共存的离子:Fe3+、K+、NH4+、 SO42-、Cl-、ClO-
D. AlCl3溶液与Na2CO3溶液混合发生反应:2Al3++3CO32-=Al2(CO3)3↓
难度: 简单查看答案及解析
-
下列说法正确的是
A. 所有反应的活化能不可能接近零
B. 弱电解质的导电性不一定比强电解质的导电性弱
C. 燃烧热是指1 mol任何物质完全燃烧生成稳定氧化物所放出的热量
D. H+ (aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1表示强酸溶液与强碱溶液反应的中和热
难度: 简单查看答案及解析
-
下列现象或操作不适宜用勒夏特列原理解释的是
A. 合成氨时将氨液化分离可提高原料的利用率
B. H2、I2、HI 混合气体加压后颜色变深
C. 新制氯水久置后颜色变浅
D. 锅炉水垢中含有 CaSO4,常先加 Na2CO3 再加酸处理
难度: 简单查看答案及解析
-
在恒温恒容下反应:2A(S)+B(g)
C(g) +D(g);△H<0 下列叙述正确的是
A. 向该容器中加入少量 A,反应速率增大
B. 向该容器中充入 He 气,反应速率增大
C. 该反应为放热反应,无需加热一定能发生
D. 将粉末状 A 代替块状 A,反应速率增大
难度: 简单查看答案及解析
-
反应Ⅰ:CaSO4(s)+4CO(g)
CaS(s)+4CO2(g) ΔH1=-175.6 kJ·mol-1反应Ⅱ:CaSO4(s)+CO(g)
CaO(s)+SO2(g)+CO2(g) ΔH2=+218.4 kJ·mol-1假设某温度下,反应Ⅰ的速率(v1)小于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( )
A.
 B.
B. 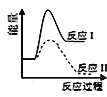
C.
 D.
D. 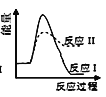
难度: 困难查看答案及解析
-
下列装置一定能证明2Ag++2I-=2Ag+I2能否自发进行的是
A.
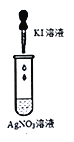 B.
B. 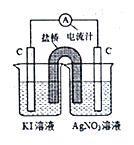
C.
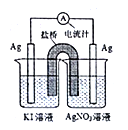 D.
D. 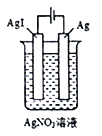
难度: 中等查看答案及解析
-
在水溶液中Fe3+和I-存在可逆反应:2Fe3++2I-
2Fe2++I2,平衡常数为K。已知氢氧化铁和氢氧化亚铁的溶度积如下:Ksp[Fe(OH)2]=4.87×10-17,Ksp[Fe(OH)3]=2.64×10-39。下列判断不正确的是
A. 反应的平衡常数K=
B. 该可逆反应只能在酸性条件下存在
C. 加入AgNO3,平衡右移,溶液黄色变浅
D. 加入CCl4,平衡右移,水溶液层黄色变浅
难度: 中等查看答案及解析