-
常温下,下列离子浓度关系正确的是
A. pH=11的氨水中,c(OH-)=c(NH4+)=10-3mol·L-1
B. pH=9的氨水和NH4Cl混合溶液中,c(Cl-)>c(NH4+)
C. 0.1 mol·L-1NH4Cl溶液中,c(H+)=c(NH3·H2O)+c(OH-)
D. 0.1 mol·L-1NH4Cl溶液中,c(Cl-)>c(H+)>c(NH4+)>c(OH-)
难度: 中等查看答案及解析
-
下列物质在水溶液中促进了水的电离的是
A. NaHSO4 B. HClO C. NaCl D. CuSO4
难度: 简单查看答案及解析
-
化学与科学、技术、社会和环境密切相关。下列有关说法中不正确的是
A. 对废旧电池进行回收处理,主要是为了环境保护和变废为宝
B. 用电解水的方法制取大量H2,可以缓解能源不足的问题
C. 为保护轮船的外壳,常在外壳上镶入锌块
D. 工业上,不能采用电解MgCl2溶液的方法制取金属镁
难度: 中等查看答案及解析
-
下列离子在溶液中因水解反应而不能大量共存的是
A. H+ 、 Cl- 、 OH- 、 Na+
B. Fe3+ 、NO3- 、S2-、 Na+
C. Ba2+ 、Al3+ 、 K+ 、 〔Al(OH)4 〕-
D. NH4+ 、CO32-、 K+ 、Cl-
难度: 中等查看答案及解析
-
下列说法中正确的是
A. 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
B. NH3的水溶液能导电,因此NH3是电解质
C. 由0.1 mol·L-1一元碱BOH的pH=10,可知溶液中存在BOH=B++OH-
D. 相同温度下,0.1 mol·L-1NH4Cl溶液中NH4+的浓度比0.1 mol·L-1氨水中NH4+的浓度大
难度: 中等查看答案及解析
-
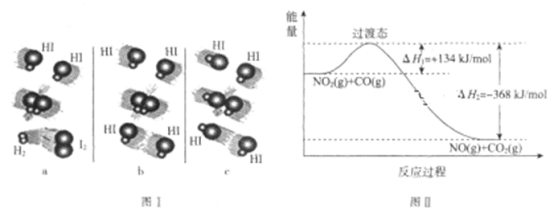
臭氧是理想的烟气脱硝试剂,其脱硝反应为2NO2(g)+O3(g)
N2O5(g)+O2(g),若反应在恒容密闭容器中进行,下列由该反应相关图像作出的判断正确的是( )
A.
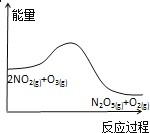 升高温度,平衡常数减小
升高温度,平衡常数减小B.
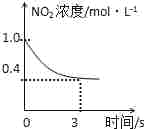 0-3s内,反应速率V (NO2)=0.2 mol•L-1
0-3s内,反应速率V (NO2)=0.2 mol•L-1C.
t1时仅加入催化剂,平衡正向移动
D.
达到平衡时,仅改变X,则X为C(O2)
难度: 中等查看答案及解析
-
(2013•吉林模拟)合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
A. 增加压强 B. 降低温度 C. 增大CO的浓度 D. 更换催化剂
难度: 中等查看答案及解析
-
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd + 2NiOOH + 2H2O
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 -e— + OH- = NiOOH + H2O
B.充电过程是化学能转化为电能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
难度: 中等查看答案及解析
-
下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
难度: 简单查看答案及解析
-
下列实验操作能达到目的是
A. 用pH试纸测定次氯酸钠溶液的pH
B. 将FeCl3溶液加热蒸干并灼烧获得Fe2O3固体
C. 向明矾溶液中加入一定量NaOH,制备Al(OH)3胶体
D. 室温下测得pH=5的NaHSO4溶液与pH=9的NaHCO3溶液中水的电离程度相等
难度: 中等查看答案及解析
-
100mL浓度为2mol·L-1的盐酸溶液跟过量的锌片反应,为减慢反应速率,又不影响生成H2的总量,可采用的方法有:
A. 加适量6mol·L-1HCl溶液 B. 加数滴CuCl2溶液
C. 加适量醋酸钠固体 D. 加适量NaNO3溶液
难度: 简单查看答案及解析
-
下图表示的是某物质所发生的
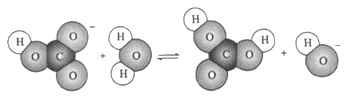
A. 置换反应 B. 水解反应 C. 中和反应 D. 电离过程
难度: 中等查看答案及解析
-
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g)
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确
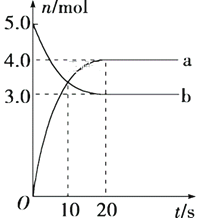
A. 曲线a表示NO2的物质的量随时间的变化
B. 10 s时,v(正)>v(逆)
C. 20 s时反应达到平衡
D. 0~20 s内平均反应速率 v(O2)=0.05 mol·L-1·s-1
难度: 困难查看答案及解析
-
某同学组装了如图所示的电化学装置电极I为Al,其他电极均为Cu,则
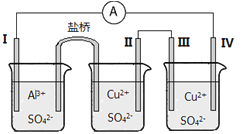
A. 电流方向:电极IV→
→电极I
B. 电极I发生还原反应
C. 电极II逐渐溶解
D. 电极III的电极反应:Cu2++2e-==Cu
难度: 中等查看答案及解析
-
在一定条件下发生反应3A(g)+2B(g)
zC(g)+2D(g),在2 L 的密闭容器中把4 mol A 和 2 mol B 混合,2 min 后反应达到平衡时生成 1.6 mol C,又测得反应速率v(D)=0.2 mol·(L·min) -1 。则下列说法不正确的是
A. z=4 B. B 的转化率是40%
C. A 的平衡浓度是1.4 mol·L-1 D. 平衡时气体压强是原来压强的0.9
难度: 中等查看答案及解析
-
已知某种微生物燃料电池工作原理如图所示。下列有关该电池的说法中,正确的是
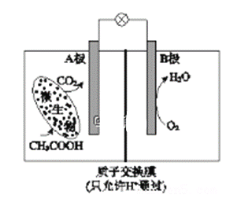
A. 外电路电子从B极移向A极
B. 溶液中H+由B极区移向A极区
C. 电池工作一段时间后B极区溶液的pH减小
D. A极电极反应式为:CH3COOH - 8e-+ 2H2O = 2CO2 + 8H+
难度: 中等查看答案及解析
-
常温时,下列关于电解质溶液的叙述正确的是
A. 稀释pH=10的氨水,溶液中所有离子的浓度均降低
B. pH均为5的盐酸和氯化铵溶液中,水的电离程度相同
C. 等浓度的碳酸钠与碳酸氢钠溶液相比,碳酸钠溶液的pH大
D. 分别中和pH与体积均相同的硫酸和醋酸,硫酸消耗氢氧化钠的物质的量多
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g) ΔH,同时符合下列两图中各曲线规律的是
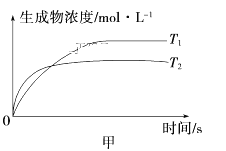
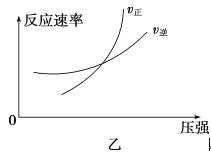
A. a+b>c+d T1>T2 ΔH>0
B. a+b>c+d T1<T2 ΔH<0
C. a+b<c+d T1>T2 ΔH>0
D. a+b<c+d T1<T2 ΔH<0
难度: 困难查看答案及解析