-
在容积恒为0.5 L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5(mol·L-1)-2 |
请完成下列问题:
(1)试比较K1、K2的大小,K1________K2(填“>”、“=”或“<”)。
(2)下列各项能做为判断该反应达到化学平衡状态的依据的是_____(填字母序号)。
a.容器内N2、H2、NH3的浓度之比为1∶3∶2
b.v正(N2)=3v逆(H2)
c.容器内压强保持不变
d.混合气体的密度保持不变
(3)400 ℃时,反应2NH3(g) N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。
-
(8分)在0.5L的密闭容器中,一定量的氮气和氢气进行
如下化学反应:N2(g)+3H2(g) 2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
2NH3(g) ⊿H<0,其化学平衡常数K与温度t的关系如右表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
请完成下列问题;
(1)试比较K1、K2的大小,K1________K2(填写“>”、“=”或“<”)
(2)下列各项能作为判断该反应达到化学平衡状态的依据是________(填序号字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.υ(N2)正=3υ(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)400℃时,反应2NH3(g)  N2(g)+3H2(g)的化学平衡常数的值为________。
N2(g)+3H2(g)的化学平衡常数的值为________。
当测得NH3和N2、H2的物质的量分别为3 mol和2 mol、1 mol时,则该反应的
υ(N2)正________υ(N2)逆 (填写“>”、“=”或“<”)
(4)(3)中反应平衡时,升高温度,NH3转化率________ (填“变大”、“变小”、“不变”)
-
氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g) 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
在200℃时,当测得NH3和N2、H2的物质的量分别为1mol和0.5mol、1mol时,则该反应的v(N2)正____v(N2)逆(填写“>”、“=”或“<”)。
(2)结合表中给出的电离常数回答下列问题:
| 酸或碱 | CH3COOH | HNO2 | HCN | HClO |
| 电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、____(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_______。
-
恒温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g)
求:(1)反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,计算a=______
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量,n(NH3)=______.
(3)原混合气体与平衡时混合气体的总物质的量之比(写出最简整数比,下同)n(始):n(平)=______
(4)原混合气体中,a:b=______
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
-
恒温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g)
求:(1)反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,计算a=______
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量,n(NH3)=______.
(3)原混合气体与平衡时混合气体的总物质的量之比(写出最简整数比,下同)n(始):n(平)=______
(4)原混合气体中,a:b=______
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
-
恒温下,将amol氮气与bmol氢气的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g)⇌2NH3(g)
求:(1)反应进行到某时刻t时,n(N2)=13mol,n(NH3)=6mol,计算a=______
(2)反应达平衡时,混合气体的体积为716.8L(标况下),其中NH3的含量(体积分数)为25%,计算平衡时NH3的物质的量,n(NH3)=______.
(3)原混合气体与平衡时混合气体的总物质的量之比(写出最简整数比,下同)n(始):n(平)=______
(4)原混合气体中,a:b=______
(5)达到平衡时,N2和H2的转化率之比,α(N2):α(H2)=______
(6)平衡混合气体中,n(N2):n(H2):n(NH3)=______.
-
Ⅰ.氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
2NH3(g);ΔH = -92.2 kJ·mol-1。一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t5 ﹑t7时刻所对应的实验条件改变分别是
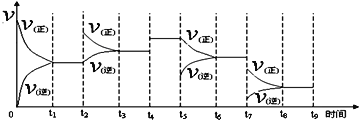
t5 ___________________。t7___________________。
Ⅱ.已知化学反应①:Fe(s)+CO2(g)  FeO(s)+CO(g), 其平衡常数为K1;
FeO(s)+CO(g), 其平衡常数为K1;
化学反应②:Fe(s)+H2O(g)  FeO(s)+H2(g),其平衡常数为K2。
FeO(s)+H2(g),其平衡常数为K2。
在温度973K和1173K情况下,K1、K2的值分别如下:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(1)1173K时,若c(CO2)=2mol/L,c(CO) =5mol/L,则此时反应①平衡向__________(填“正”或“逆”)反应方向移动。
(2)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
CO(g)+H2O(g),写出该反应的平衡常数K3的表达式:K3=_______________________(用K1 、 K2表示)。据此关系式及上表数据,能推断出反应③是______(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是______(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积 C.降低温度
D.升高温度 E.使用合适的催化剂 F.设法减少CO的量
能判断反应③已达平衡状态的是_______________________________。
A.恒容容器中压强不变 B.混合气体中c(CO)不变
C. (H2)==
(H2)== (H2O) D.c(CO2)==c(CO)
(H2O) D.c(CO2)==c(CO)
(3)723K时,0.2molCO2和0.1molH2通入抽空的1L恒容密闭容器中,发生反应③,达到平衡后水的物质的量分数为0.1。则H2的转化率α(H2)=___________%。723K该反应的平衡常数为K=________________。(结果保留两位有效数字)
-
(9分)氢气是工业上重要的原料。
(1)氢气用于工业合成氨 N2(g) + 3H2(g)  2NH3(g);ΔH = -92.2 kJ·mol-1。
2NH3(g);ΔH = -92.2 kJ·mol-1。
①一定温度下,在容积恒定的密闭容器中,一定量的N2和H2反应达到平衡后,改变某一外界条件,反应速率与时间的关系如下图所示,其中t2 ﹑t4 ﹑t5 ﹑t7时刻所对应的实验条件改变分别是
t2________t4 ________t5 ________ t7________。
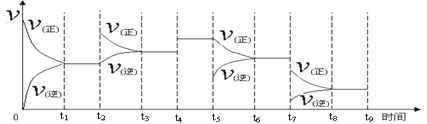
②温度为T℃时,将2amolH2和amolN2放入0.5L密闭容器中,充分反应后测得N2的转化率为50﹪,此时放出热量46.1 kJ。则该温度下反应的平衡常数为________。
(2)在容积相同的两密闭容器A和B中,保持温度为423K,同时向A、B中分别加入1mol及2mol碘化氢待反应:2HI(g) H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
H2(g)+I2(g) 达到平衡后,平衡时I2的浓度c(I2)A________c(I2)B ;平衡时HI的分解率αA________αB ;平衡时H2在混合气体中的体积分数A________B (填写“>”“<”“=”)
-
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2  2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
-
恒温下,将a mol N2与b mol H2的混合气体通入一个固定容积为2L的密闭容器中,发生如下反应:N2+ 3H2  2NH3。
2NH3。
(1)若反应进行5min时,测得n(N2) = 1.8mol,n(NH3) = 0.4mol。
计算:①a的值; ②用H2浓度的变化表示的反应速率。
(2)反应达平衡时,混合气体的总物质的量为5.0mol,其中NH3的含量(体积分数)为40%。
计算:上述温度下该反应的化学平衡常数。
2NH3(g) ΔH<0,其化学平衡常数K与t的关系如下表:
N2(g)+3H2(g)的平衡常数K为____。当测得NH3、H2、N2的物质的量分别为3 mol、1 mol、2 mol时,则该反应的v正(N2)___ v逆(N2)(填“>”、“=”或“<”)。

