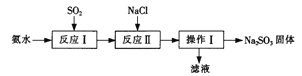
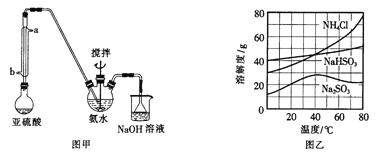
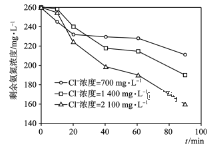
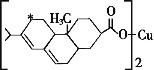
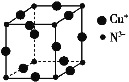
-
下列说法正确的是( )
A. 向新制Cu(OH)2悬浊液中加入蔗糖溶液,加热,出现红色沉淀
B. 向鸡蛋清溶液中加入饱和(NH4)2SO4溶液,蛋白质变性,出现白色沉淀
C. 常温下,向浓硫酸中加入铁片,铁片溶解
D. 向FeCl3溶液中加入少量铜粉,铜粉溶解
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y和Z的原子序数依次增大,W的阴离子核外电子数与X原子的内层电子数相同,X的一种核素在考古时常用来鉴定一些文物的年代,Y的单质在空气中的体积分数最大,Z是金属性最强的短周期元素。下列说法中正确的是( )
A. 原子半径:r(W)<r(X)<r(Y)<r(Z)
B. W、X、Y、Z原子的最外层电子数之和为10
C. W与X可形成含非极性键的化合物
D. X的最高价氧化物的水化物酸性比Y的强
难度: 中等查看答案及解析
-
糖类是人体所需的重要营养物质。淀粉分子中不含的元素是
A.氢 B.碳 C.氮 D.氧
难度: 简单查看答案及解析
-
下列有关氧元素及其化合物的表示正确的是( )
A.质子数为8、中子数为10的氧原子:
B.氧原子的结构示意图:
C.水分子的电子式:
D.乙酸甲酯的结构简式:HCOOC2H5
难度: 简单查看答案及解析
-
下列有关物质性质与用途具有对应关系的是( )
A.硅酸钠溶液呈碱性,可用作木材防火剂
B.氧化铝的熔点很高,可用于制作耐高温材料
C.二氧化硫具有漂白性,可用作制溴工业中溴的吸收剂
D.乙烯具有还原性,可用作水果的催熟剂
难度: 中等查看答案及解析
-
室温下,下列各组离子在指定溶液中能大量共存的是( )
A.pH=12的溶液:Na+、K+、NO3-、ClO-
B.能使甲基橙变红的溶液:Na+、NH4+、Cl-、CH3COO-
C.1.0 mol·L-1的KNO3溶液:Fe2+、H+、SO42-、I-
D.0.1 mol·L-1 Ba(OH)2溶液:Al3+、NH4+、NO3-、HCO3-
难度: 中等查看答案及解析
-
实验室用下列装置制取、提纯、收集Cl2、尾气处理,不能达到实验目的是( )
A.
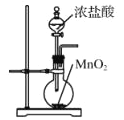 制取Cl2
制取Cl2B.
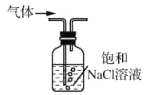 除去Cl2中的少量HCl
除去Cl2中的少量HClC.
 收集Cl2
收集Cl2D.
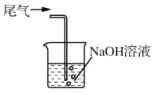 吸收尾气中的Cl2
吸收尾气中的Cl2难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是
A. 室温下用稀NaOH溶液吸收Cl2:Cl2+2OH−
ClO−+Cl−+H2O
B. 用铝粉和NaOH溶液反应制取少量H2:Al+2OH−
+H2↑
C. 室温下用稀HNO3溶解铜:Cu+2
+2H+
Cu2++2NO2↑+H2O
D. 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+
H2SiO3↓+2Na+
难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.N2(g)
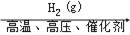 NH3(g)
NH3(g)NH4Cl(aq)
B.Fe(s)
FeCl2(s)
Fe(OH)2(s)
C.MgO(s)
MgSO4(aq)
Mg(s)
D.S(s)
SO2(g)
BaSO3(s)
难度: 简单查看答案及解析
-
我国科学家研发了一种室温下“可呼吸”的Na-CO2二次电池,将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为3CO2+4Na
2Na2CO3+C。下列说法错误的是( )
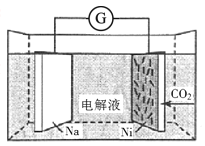
A.放电时,ClO4-向负极移动
B.充电时释放CO2,放电时吸收CO2
C.放电时,正极反应为3CO2+4e-=2CO32-+C
D.充电时,阳极反应为Na++e-=Na
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.氢氧燃料电池放电时化学能全部转化为电能
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应ΔH>0
C.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目小于6×6.02×1023
D.在酶催化淀粉水解反应中,温度越高淀粉水解速率越快
难度: 中等查看答案及解析
-
根据下列实验操作和现象所得出的结论正确的是
选项
实验操作和现象
结论
A
向苯酚浊液中滴加Na2CO3溶液,浊液变清
苯酚的酸性强于H2CO3的酸性
B
向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色
I2在CCl4中的溶解度大于在水中的溶解度
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+的氧化性强于Cu2+的氧化性
D
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgCl) >Ksp(AgI)
A. A B. B C. C D. D
难度: 中等查看答案及解析
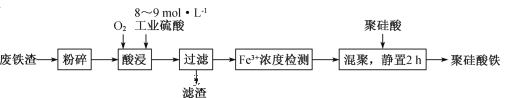
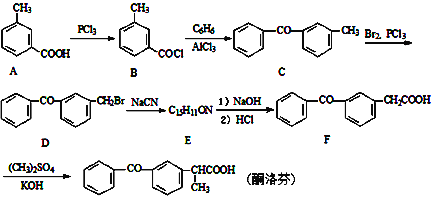
 __________________________
__________________________