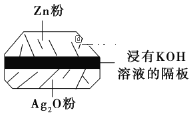
-
化学与生产、生活密切相关。下列事实与化学反应速率无关的( )
A. 食品、蔬菜贮存在冰箱和冰柜里,能延长保鲜时间
B. 家用铁锅、铁铲等餐具保持干燥,能减缓生锈
C. 制造蜂窝煤时加入生石灰,减少SO2排放
D. 煤气换成天然气时,要调整灶具进气(或出气)管
难度: 简单查看答案及解析
-
下表中物质的分类组合完全正确的是
选项
A
B
C
D
强电解质
KNO3
H2SO4
BaSO4
HClO4
弱电解质
HF
CaCO3
HClO
NH3
非电解质
SO2
金属Al
H2O
C2H5OH
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
构造原理揭示的电子排布能级顺序,实质是各能级能量高低顺序.若以E表示某能级的能量,下列能量大小顺序中正确的是( )
A.E(4f)>E(4s)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(3s)>E(3p)>E(3d) D.E(5s)>E(4s)>E(4f)
难度: 简单查看答案及解析
-
已知反应X(g)+3Y(g)
2Z(g) △H的能量变化如下图所示。下列说法正确的是
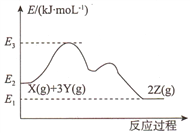
A.△H= E2- E1 B.更换高效催化剂,E3不变
C.恒压下充入一定量的氦气n(Z)减少 D.压缩容器,c(X)减小
难度: 中等查看答案及解析
-
下列叙述中正确的是( )
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.如果某一基态原子3p能级上仅有2个电子,它们的自旋状态必然相反
难度: 简单查看答案及解析
-
下列事实一定能证明HNO2是弱电解质的是( )
①常温下NaNO2溶液的pH大于7 ②用HNO2溶液做导电实验,灯泡很暗 ③HNO2和NaCl不能发生反应 ④0.1 mol·L-1 HNO2溶液的pH=2.1 ⑤NaNO2和H3PO4反应,生成HNO2 ⑥0.1 mol·L-1 HNO2溶液稀释至100倍,pH约为3.9
A.①④⑥ B.①②③④ C.①④⑤⑥ D.全部
难度: 简单查看答案及解析
-
25℃时,下列溶液中水的电离程度最小的是
A.pH=11的氨水 B.0.01 mol/L的Na2CO3溶液
C.0.01 mol/L的盐酸 D.pH=4的NaHSO3溶液
难度: 中等查看答案及解析
-
科学家提出如下光分解法制备氢气:
①2Ce4+(aq)+H2O(l)===2Ce3+(aq)+
O2(g)+2H+(aq) ΔH1
②Ce3+(aq)+H2O(l)===Ce4+(aq)+
H2(g)+OH-(aq) ΔH2
③H2O(l)===H+(aq)+OH-(aq) ΔH3
④2H2O(l)===2H2(g)+O2(g) ΔH4
下列说法正确的是( )
A. Ce4+能够增大水分解反应的活化能,提高反应速率
B. Ce3+是反应②和反应③的催化剂
C. 上述反应中,ΔH4=2ΔH1+4ΔH2-4ΔH3
D. 通常条件下,反应④中生成H2、O2的速率之比为1∶2
难度: 简单查看答案及解析
-
今有室温下四种溶液,下列有关叙述不正确的是( )

A. ③和④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②和③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH:①>②>④>③
D. V1 L ④与V2L ①溶液混合后,若混合后溶液pH=7,则V1<V2
难度: 困难查看答案及解析
-
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g)
2NH3(g) ΔH<0,反应过程如图,下列说法正确的是( )
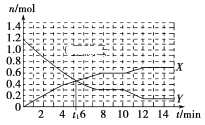
A.t1 min时正、逆反应速率相等
B.X曲线表示NH3的物质的量随时间变化的关系
C.0~8min,H2的平均反应速率v(H2)=
mol·L-1·min-1
D.10min,改变条件为升温
难度: 简单查看答案及解析
-
25℃时,氢氟酸电离常数Ka=6.8×10-4mol·L-1,醋酸电离常数Ka=1.8×10-5mol·L-1。如图表示25℃时氟化钠和醋酸钠溶液的浓度和Y的关系。则Y可以表示( )

A.溶液的pH B.水解平衡常数
C.水解百分率 D.溶液中阴离子浓度之和
难度: 简单查看答案及解析
-
自2016年1月1日起,无线电动工具中使用的镍镉电池将在欧盟全面退市。镍镉电池放电时的总反应为Cd+2NiO(OH)+2H2O=2Ni(OH)2+Cd(OH)2,(镉的原子量112)下列说法正确的是( )
A.电池的电解液为碱性溶液,正极为2NiO(OH)、负极为Cd
B.放电时,每通过2mol电子,负极质量减轻112 g
C.放电时,电子从正极流向电源的负极
D.充电时,Cd极板应与外电源的正极相接
难度: 中等查看答案及解析
-
全世界每年钢铁因锈蚀造成大量的损失。某城市拟用如图方法保护埋在酸性土壤中的钢质管道,使其免受腐蚀。关于此方法,下列说法不正确的是( )
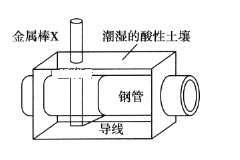
A.土壤中的钢铁易被腐蚀是因为在潮湿的土壤中形成了原电池
B.金属棒X的材料应该是比镁活泼的金属
C.金属棒X上发生反应:M-ne-=Mn+
D.这种方法称为牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
难度: 简单查看答案及解析
-
前四周期元素中,基态原子中未成对电子数与其所在周期数相同的元素有
A.3种 B.4种 C.5种 D.6种
难度: 简单查看答案及解析
-
浓度均为0.10mol/L、体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随
的变化如图所示,下列叙述错误的是( )
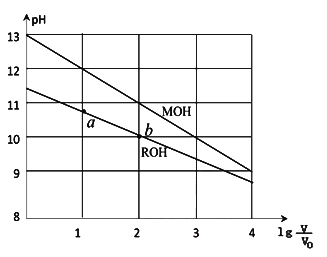
A.MOH的碱性强于ROH的碱性
B.ROH的电离程度:b点大于a点
C.若两溶液无限稀释,则它们的c(OH-)相等
D.当
=2时,若两溶液同时升高温度,则
增大
难度: 中等查看答案及解析
-
以下有关元素性质的说法不正确的是( )
A.具有下列电子排布式的原子中,①1s22s22p63s23p2②1s22s22p3③1s22s22p2④1s22s22p63s23p4,原子半径最大的是①
B.下列原子的外围电子排布中,①3s23p1②3s23p2③3s23p3④3s23p4,对应的第一电离能最大的是③
C.①Na、K、Rb ②N、P、As ③O、S、Se ④Na、P、Cl,元素的电负性随原子序数的增加而递增的是④
D.某元素的逐级电离能(kJ/mol)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时最可能生成的阳离子是③ ①X+②X2+③X3+④X4+
难度: 简单查看答案及解析
-
已知:锂离子电池的总反应为:LixC+Li1-xCoO2
C+LiCoO2,锂硫电池的总反应为:2Li+S
Li2S,有关上述两种电池说法正确的是

A.锂离子电池放电时,Li+向负极迁移
B.锂硫电池充电时,锂电极发生还原反应
C.理论上两种电池的比能量相同
D.上图表示用锂离子电池给锂硫电池充电
难度: 中等查看答案及解析
-
已知Ksp(CaCO3)=2.8×10-9及表中有关信息:
弱酸
CH3COOH
H2CO3
电离平衡常数(常温)
Ka=1.8×10-5
Ka1=4.3×10-7;
Ka2=5.6×10-11
下列判断正确的是
A.向Na2CO3溶液中滴入酚酞,溶液变红,主要原因是CO32-+2H2O
H2CO3+2OH-
B.常温时,CH3COOH与CH3COONa混合溶液的pH=6,则c(CH3COOH)/c(CH3COO-)=18
C.NaHCO3溶液中:c(OH-)-c(H+)=c(H2CO3)-c(CO32-)
D.2×10-4 mol/L的Na2CO3溶液与CaCl2溶液等体积混合出现沉淀,则CaCl2溶液的浓度一定是5.6×10-5 mol/L
难度: 困难查看答案及解析
-
已知S2O82-+2I-=2SO42-+I2(慢),I2+2S2O32-=2I-+S4O62-(快)。探讨K2S2O8浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号
体积/mL
K2S2O8
溶液
水
KI溶液
Na2S2O3溶液
淀粉溶液
①
10.0
0.0
4.0
V3
2.0
②
9.0
1.0
V2
4.0
2.0
③
8.0
V1
4.0
4.0
2.0
下列结论正确的是( )
A.V1=0 V2=2.0 B.V1=2.0 V3=2.0
C.V1=2.0 V2=4.0 D.V2=4.0 V3=2.0
难度: 简单查看答案及解析