-
有一铁的氧化物样品,用50mL 5mol·L-1盐酸可恰好使其完全溶解。所得溶液可吸收标准状况下0.56L氯气,使其中的Fe2+全部转化为Fe3+。该样品可能的化学式为
A. Fe4O5 B. Fe3O4 C. Fe5O7 D. Fe8O11
难度: 中等查看答案及解析
-
《电石安全技术说明书》中对电石的描述为“…遇水或湿气能迅速产生高度易燃的乙炔气体,应与氧化剂类物质分开存放…”。下列说法不合理的是( )
A.盛装电石的包装上贴有的危险化学品标志为(遇湿易燃)

B.电石与硝酸分开存放
C.运输电石的铁桶内可充入氮气
D.电石着火可用泡沫灭火器扑灭
难度: 中等查看答案及解析
-
在一些高档茶叶、点心等食品的包装盒中有一个小袋,将小袋打开,可看到灰黑色粉末,其中有些已变成棕褐色。将灰黑色粉末溶于盐酸,取上层清液,滴入几滴氯水,再滴入KSCN溶液,马上出现血红色。以下结论不正确的是
A.该灰黑色粉末作抗氧化剂 B.该灰黑色粉末不可食用
C.小袋中原来装有铁粉 D.小袋中原来装有Fe2O3
难度: 中等查看答案及解析
-
实验室根据侯氏制碱原理制备少量 NaHCO3 固体的四个主要步骤中,不能实现实验目的的是
A.制取氨气
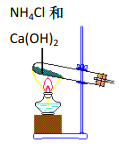 B.制取碳酸氢钠
B.制取碳酸氢钠 C.分离碳酸氢钠
C.分离碳酸氢钠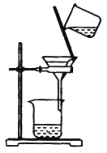 D.干燥碳酸氢钠
D.干燥碳酸氢钠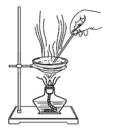
难度: 中等查看答案及解析
-
钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、耐腐蚀等,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A.用来作保险丝 B.用于制造航天飞机
C.用来制造人造骨 D.用于家庭装修,作钛合金装饰门
难度: 简单查看答案及解析
-
下列离子方程式不正确的是 ( )
A.氨气通入稀硫酸中:NH3+H+=NH4+
B.二氧化碳通入碳酸钠溶液中:CO2+CO
+H2O=2HCO3-
C.磁性氧化铁与浓盐酸反应:Fe3O4+8H+=Fe2++2Fe3++4H2O
D.澄清石灰水与过量的小苏打溶液反应:Ca2++OH-+HCO
=CaCO3↓+H2O
难度: 中等查看答案及解析
-
如下图表示AlCl3溶液与NaOH溶液相互滴加过程中微粒的量的关系曲线。下列判断错误的是( )
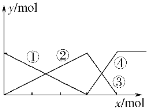
A.①线表示Al3+的物质的量的变化
B.x表示AlCl3的物质的量
C.③线表示Al(OH)3的物质的量的变化
D.④线表示AlO2-的物质的量的变化
难度: 中等查看答案及解析
-
下面有关铜的化合物的性质叙述中正确的是
A.CuSO4变成CuSO4·5H2O是物理变化
B.一定条件下,新制的Cu(OH)2浊液能与乙醛反应但不能与乙酸反应
C.CuO是黑色固体,与水反应可生成Cu(OH)2
D.Cu2O遇硝酸可能会被氧化成Cu2+
难度: 中等查看答案及解析
-
下列实验设计能够成功的是( )
选项
实验目的
实验步骤及现象
A
检验亚硫酸钠试样是否变质
试样
 白色沉淀
白色沉淀沉淀不溶解
B
检验某盐是否为铵盐
试样
产生使湿润的红色石蕊试纸变蓝的气体
C
证明酸性条件下H2O2氧化性比I2强
NaI溶液
 溶液变蓝色
溶液变蓝色D
除去硝酸钾晶体中少量氯化钠
试样
硝酸钾
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列叙述不正确的是( )
①工业上用电解氯化钠溶液的方法制取钠
②可以用钠加入氯化镁的饱和溶液中制取金属镁
③用于电冶铝的原料是氯化铝
④炭在高温下能还原氧化镁中的镁
A.①②③④ B.①②③ C.①③ D.①
难度: 中等查看答案及解析
-
下列物质的转化在指定条件下能实现的是
A.Cu
Cu2(OH)2CO3
Cu(OH)2
B.MgO
MgCl2(aq)
MgCl2(s)
C.CaCl2(aq)
CaCO3
CaSiO3
D.S
SO3
H2SO4
难度: 中等查看答案及解析
-
下列反应中,氧化剂和还原剂的物质的量之比最大的是( )
A. 氯气和氨气 3Cl2 + 8NH3 = N2 + 6NH4Cl
B. 铜和稀硝酸3Cu + 8HNO3(稀) = 2NO↑+ 3Cu(NO3)2 + 4H2O
C. 氢气和氧化铁 3H2 + Fe2O3
2Fe + 3H2O
D. 二氧化锰和盐酸 MnO2 + 4HCl(浓)
MnCl2 + Cl2↑+ 2H2O
难度: 中等查看答案及解析
-
一定温度下,向饱和NaOH溶液中投入一小块金属钠,充分反应后恢复到原来的温度。下列叙述中不合理的是( )
A.钠浮于液面,到处游动,发出嘶嘶响声
B.溶液的质量减少,NaOH的物质的量浓度不变
C.溶液中NaOH的质量分数不变,有H2放出
D.溶液中溶质的质量增大,并放出H2
难度: 中等查看答案及解析
-
常温下,有pH=1的某溶液中可能有Na+、Fe3+、Fe2+、I﹣、Cl﹣、CO32﹣中的某几种,现取100mL该溶液进行如下实验:已知氧化性Fe3+>I2,根据实验结果,下列判断正确的是( )
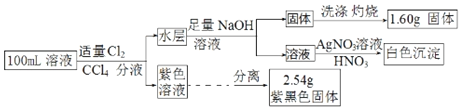
A.Fe3+、I﹣、Cl﹣三种离子一定存在
B.不能确定Na+和Cl﹣是否存在,CO32﹣一定不存在
C.Fe3+与Fe2+至少有一种
D.该溶液中c(Cl﹣)≥0.3mol•L‑1
难度: 中等查看答案及解析
-
常温下,向Na2CO3溶液中逐滴滴入0.1mol·L-1盐酸,溶液的pH随着滴入盐酸溶液体积变化曲线如下图,则下列说法正确的是( )
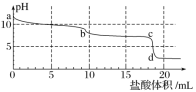
A.a点时溶液pH=11.5,原因是:CO32—+2H2O===H2CO3+2OH-
B.a~b段发生反应为:CO32—+2H+===CO2↑+H2O
C.b~c段发生反应为:HCO3—+H+===CO2↑+H2O
D.c~d段发生反应为:H++OH-===H2O
难度: 简单查看答案及解析

 ×100%
×100% B.
B. C.
C. D.
D.