-
化学与生活密切相关,下列说法错误的是
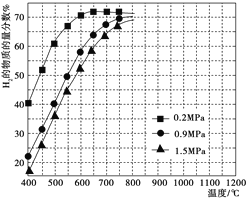
A.石油、天然气和煤等化石能源都是一次能源
B.氢能是一种理想的绿色能源,现在的科学技术水平已经那个全面推广使用氢能
C.开发太阳能、水能、风能等新能源,减少使用有害物质对环境的污染
D.2CO(g)+O2(g)
2CO2(g) ΔH=-566kJ·mol-1 ,CO的燃烧热为283kJ·mol-1
难度: 简单查看答案及解析
-
下列化学用语所表示的微粒,对水的电离平衡没有影响的是
A.
 B.
B.C.S2- D.
难度: 简单查看答案及解析
-
下列叙述正确的是
A.反应活化能越高,该反应越易进行
B.在恒温条件下,增大压强,化学反应速率一定加快
C.强电解质溶液中一定不存在电离平衡
D.某温度下,一元弱酸HA的Ka越小,则NaA的Kh(水解平衡常数)越大
难度: 简单查看答案及解析
-
下列说法正确的是
A.装置可用于蒸干AlCl3饱和溶液制备AlCl3晶体
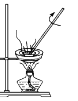
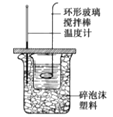
B.装置可测定中和反应反应热
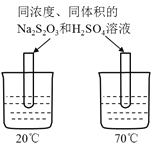
C.图丙装置可以探究温度对Na2S2O3溶液与H2SO4反应的影响
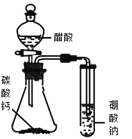
D.图丁装置可以论证醋酸、碳酸、硼酸的酸性强弱顺序为:醋酸>碳酸>硼酸
难度: 中等查看答案及解析
-
下列表示化学过程的化学用语书写正确的是
A.用中和热表示氢氧化钠和醋酸的稀溶液反应的热化学方程式为:H+(aq)+OH-(aq)=H2O(l) △H=57.3kJ·mol-1
B.AlCl3溶液与NaAlO2溶液混合:A13++A1O2-+3H2O
2Al(OH)3↓
C.HCO3-的电离:HCO3-+H2O
CO32-+H3O+
D.Na2SO3的水解:SO32-+2H2O
H2SO3+2OH-
难度: 中等查看答案及解析
-
下列说法正确的是
A.FeCl3和MnO2均可加快H2O2分解,同等条件下二者对H2O2分解速率的改变相同
B.使用催化剂能够降低化学反应的反应热(△H)
C.Na与H2O的反应是熵增的放热反应,该反应能自发进行
D.金属发生吸氧腐蚀时,被腐蚀的速率与氧气浓度无关
难度: 中等查看答案及解析
-
下列事实不能用勒夏特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.实验室中常用排饱和食盐水的方法收集氯气
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
难度: 简单查看答案及解析
-
已知2NH3(g)+3Cl3(g)=N2(g)+6HCl(g)ΔH,已知反应的相关的化学键键能数据如下:
化学键
Cl-Cl
N-H
N≡N
H-Cl
O-H
E/(kJ·mol-1)
242.7
390.8
946
431.8
463
由此计算△H为
A.+463.9kJ·mol-1 B.-463.9kJ·mol-1
C.+231.95kJ·mol-1 D.-231.95kJ·mol-1
难度: 中等查看答案及解析
-
(在一定温度下的恒容密闭容器中,下列叙述不是可逆反应A(g)+3B(g)⇌2C(g)达到平衡状态标志的是
①生成C的速率与C分解的速率相等
②单位时间内生成a mol A,同时生成3a mol B
③A、B、C的浓度不再变化
④A、B、C的质量不再变化
⑤混合气体的总压强不再变化
⑥混合气体的物质的量不再变化
⑦单位时间内消耗a mol A,同时生成3a mol B
⑧A、B、C的分子数之比为1:3:2.
A.②⑧ B.①⑥ C.②④ D.③⑧
难度: 中等查看答案及解析
-
将BaO2放入密闭真空容器中,反应2BaO2(s)
2BaO(s)+O2(g)达到平衡,保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变
C.氧气压强减小 D.BaO2量增加
难度: 中等查看答案及解析
-
下列实验操作、现象以及结论均正确的是
实验操作及现象
结论
A
取 20.00 mL盐酸
在50mL酸式滴定管中装入盐酸,调整初始读数为30.00mL后,将剩余盐酸放入锥形瓶
B
FeCl3+3KSCN
Fe(SCN)3+3KCl在平衡体系中加入KCl晶体溶液颜色无明显变化
加入KCl晶体,氯离子浓度增大,但该平衡不移动
C
加热FeCl3饱和溶液制备Fe(OH)3胶体
水解过程是吸热过程
D
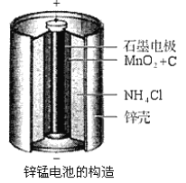
用广泛pH试纸测得NH4Cl溶液的pH为5.8
NH4Cl水解呈酸性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)
Si(s)+4HCl(g);ΔH=+QkJ·mol-1(Q>0),某温度、压强下,将一定量反应物通入密闭容器进行以上反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1mol,则达平衡时,吸收热量为QkJ
C.反应至4min时,若HCl浓度为0.12mol·L-1,则H2反应速率为0.03mol·L-1·min-1
D.当反应吸收热量为0.025QkJ时,生成的HCl通入100mL1mol·L-1的NaOH溶液恰好反应
难度: 简单查看答案及解析
-
下列有关电解质溶液的说法正确的是
A.在蒸馏水中滴加浓H2SO4,Kw不变
B.常温下,等体积的盐酸和甲酸溶液相比,前者的导电能力强
C.相同温度时,1mol/L醋酸与0.5mol/L的醋酸中,c(H+)之比为2:1
D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同
难度: 困难查看答案及解析
-
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
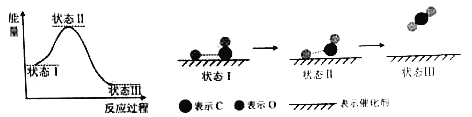
下列说法中正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ →状态Ⅲ表示CO与O2反应的过程
难度: 中等查看答案及解析
-
在T℃,将amolN2和bmolO2 充入体积为IL 的密闭容器中发生反应: N2(g)+O2(g) = 2NO(g) △H=181.5kJ/mol,反应过程中v正与v逆的变化如图所示。下列说法正确的是
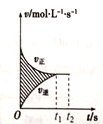
A.若t1时NO为cmol,则0~t1时间段内平均反应速率v(N2)=
B.t1~t2时间段内v正(O2)=2v逆(NO)
C.图中所示的阴影部分面积的含义是v正与v逆的差
D.其他条件不变,t2时刻升高温度,v正与v逆均增大,且v正>v逆
难度: 中等查看答案及解析
-
T℃时,将2.0molA(g)和2.0molB(g)充入体积为1L的密闭容器中,在一定条件发生下述反应:A(g)+B(g)
2C(g)+D(s) △H<0;t时刻反应达到平衡时,C(g)为2.0mol。下列说法正确的是
A.t时刻反应达到平衡时,A(g)的体积分数为20%
B.T℃时该反应的化学平衡常数Kc=2
C.t时刻反应达到平衡后,缩小容器体积,平衡逆向移动
D.相同条件下,若将1.0molA(g)和1.0molB(g)充入同样容器,达到平衡后,A(g)的转化率为50%
难度: 中等查看答案及解析
-
下列反应中符合图像的是
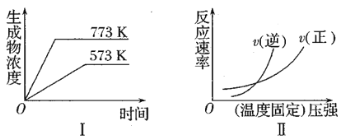
A.2SO3(g)
2SO2(g)+O2(g) △H=+Q2kJ·mol-1(Q2>0)
B.H2(g)+CO(g)
C(s)+H2O(g) △H=+Q4kJ·mol-1(Q4>0)
C.N2(g)+3H2(g)
2NH3(g) △H =-Q1kJ·mol-1 (Q1>0)
D.4NH3(g)+5O2(g)
4NO(g)+6H2O(g) △H =-Q3kJ·mol-1 (Q3>0)
难度: 中等查看答案及解析
-
用CO合成甲醇(CH3OH)的化学反应方程式为CO(g)+2H2(g)
CH3OH(g) △H<0
按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
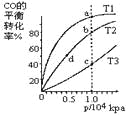
A.平衡常数:K(a)>K(c) K(b)=K(d)
B.正反应速率:v(a)>v(c) v(b)>v(d)
C.平均摩尔质量:M(a)<M(c) M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
难度: 中等查看答案及解析
-
H2S水溶液中存在电离平衡H2S
HS-+H+和HS-
S2-+H+,若向溶液中
A.加硫酸,平衡向右移动,溶液中氢离子浓度增大
B.通入过量SO2气体,平衡向左移动,溶液pH值增大
C.通入氯气,溶液pH值增大
D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
难度: 中等查看答案及解析
-
已知 H2CO3
HCO3-+H+ K1=4.3×10-7 HCO3
CO32-+H+ K2=5.6×10-11
HClO
ClO-+H+ K=3.0×10-8
H2SO3
HSO3-+H+ K1=1.54×10-2 HSO3-
SO32-+H+ K2=1.02×10-11
根据电离平衡常数分析,下列各式中正确的是
A.少量 CO2 通入 NaClO 溶液中: CO2+H2O+2ClO− = CO32-+2HClO
B.少量 SO2 通入 Ca(ClO)2 溶液中: SO2+H2O+Ca2++2ClO− ═ CaSO3↓+2HClO
C.空气中CO2和水蒸气与Ca(ClO)2溶液反应:Ca2++2ClO−+CO2+H2O ═ CaCO3↓+2HClO
D.相同浓度 NaHCO3 溶液与 NaHSO3 溶液等体积混合: H++HCO3- ═ CO2↑+H2O
难度: 中等查看答案及解析
-
用水稀释0.1mol/L氨水时,溶液中随着水量的增加而减小的是
A.
B.
C.c(H+) D.n(OH-)
难度: 中等查看答案及解析
-
下列叙述正确的是
A.由水电离出的c(H+)=1×10-12mol/L的溶液中可能大量存在K+、I-、Mg2+、NO3-
B.向0.1mol/L、pH=1的NaHA溶液中加入NaOH溶液的离子方程式:HA-+OH-=A2-+H2O
C.两种醋酸的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
D.常温下,pH=3的醋酸与pH=11的氢氧化钠溶液等体积混合后,溶液pH<7
难度: 中等查看答案及解析
-
下列溶液中微粒的物质的量浓度关系正确的是
A.0.1mol•L-1NaHCO3溶液:c(Na+)>c(OH-)>c(HCO3-)>c(H+)
B.室温下,向0.01mol•L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(H+)=c(OH-)
C.Na2CO3溶液: c(Na+)+c(H+)=c(HCO3-)+2c(H2CO3)
D.25℃时,浓度均为0.1mol•L-1的CH3COOH和CH3COONa等体积混合溶液:c(CH3COOH)+ c(CH3COO-)=0.2mol/L
难度: 中等查看答案及解析
-
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g) + 2B(g)
xC(g)ΔH=-192kJ·mol-1。向M、N中都通入1molA和2molB的混合气体,初始M、N容积相同,保持温度不变。下列说法正确的是
A.若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B.若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C.若x<3,C的平衡浓度关系为:c(M)>c(N)
D.x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
难度: 中等查看答案及解析
-
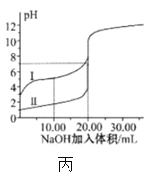
下列图示与对应的叙述相符的是
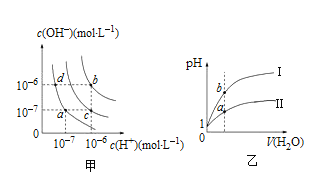
A.图甲中纯水仅升高温度,就可以从a点变到c点
B.图甲中在b点对应温度下,将pH=2的H2SO4溶液与pH=10的NaOH溶液等体积混合后,溶液显中性
C.图乙表相同温度下pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
D.图丙表示20oC时用0.100mol/L氢氧化钠溶液分别滴定20.00mL0.100mol/L的盐酸和醋酸,V(NaOH)=20.00mL时,两份溶液中c(Cl-)=c(CH3COO-)
难度: 中等查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
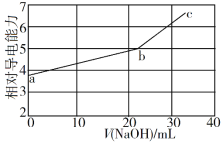
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析
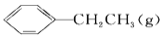
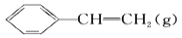 +H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的
+H2(g) ΔH=+124 kJ·mol-1,若反应体系达到平衡后,各物质的浓度在不同条件下(只改变一种条件)的变化状况如图所示(第10 min到14 min的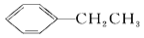 浓度变化曲线未表示出):
浓度变化曲线未表示出):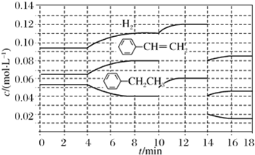
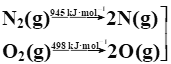
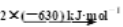 2NO(g)
2NO(g)